近日,基礎醫學院高成江教授團隊在Cell Reports雜誌(中科院一區,IF=9.423)發表以“The protein arginine methyltransferase PRMT1 promotes TBK1 activation through asymmetric arginine methylation”為題的研究成果。山東大學基礎醫學院博士研究生閻珍珍、吳海峰為論文共同第一作者,山東大學基礎醫學院高成江教授為本文的通訊作者,山東大學為第一作者單位和唯一通訊作者單位。
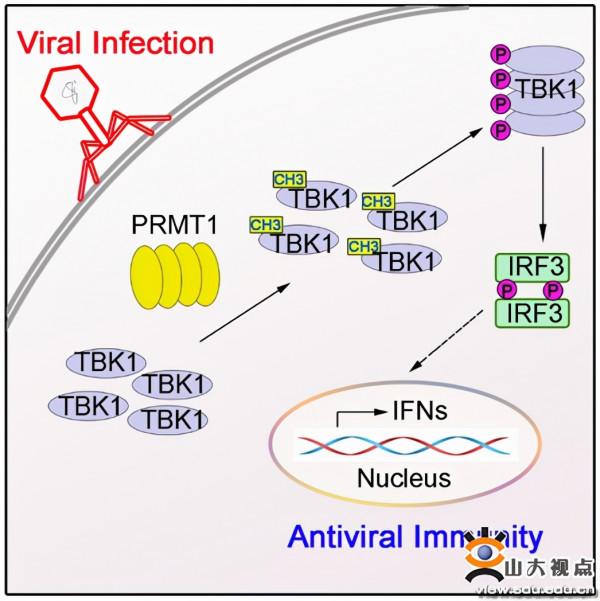
天然免疫是機體抵抗病原體入侵的第一道防線。TBK1激酶是抗病毒天然免疫訊號通路中的樞紐分子,TBK1活化後可促使下游轉錄因子IRF3發生磷酸化,進而二聚化,入核,誘發І型干擾素和其它抗病毒相關分子的表達。蛋白翻譯後修飾對TBK1的活性調控至關重要,高成江教授團隊之前的研究顯示E3泛素連線酶RNF128參與TBK1的活性調節(Nature Immunology,2017),但其它蛋白質翻譯後修飾調控TBK1的活化機制尚不清晰。
高成江教授團隊透過對蛋白精氨酸甲基轉移酶(PRMT)家族成員進行篩選,發現І型精氨酸甲基轉移酶PRMT1在抗病毒免疫反應中發揮正向調控的功能,PRMT1髓系細胞特異性敲除小鼠在病毒感染後的死亡率更高。進一步研究發現,PRMT1可以與TBK1發生特異性結合,並在病毒刺激後增強TBK1的非對稱二甲基化水平。機制研究發現,TBK1的甲基化修飾可促進其多聚化,TBK1的多聚化進一步誘發了其自身磷酸化從而活化下游訊號通路。這一研究揭示了一種新的TBK1蛋白翻譯後修飾形式,進一步完善了抗病毒訊號通路的調控機制。
高成江教授團隊長期致力於天然免疫訊號轉導的調控機制研究,研究成果發表在Nature Immunology,Journal of Experimental Medicine,Nature Communications,PLOS Pathogens等國際權威雜誌上。上述研究得到山東大學攀登計劃創新群體專案、國家自然科學基金重點專案等專案資助。鮑時來研究員(中國科學院遺傳與發育生物學研究所)提供Prmt1fl/fl小鼠。
文章連結:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)01180-3