基因表達的精準調控,對機體發育和細胞的各種生理功能的維持至關重要。基因表達的紊亂,則影響著眾多的生理和病理過程。轉錄是基因表達調控最關鍵的步驟,因此轉錄調控機制的研究一直是分子生物學的核心課題。真核生物大多數基因的轉錄主要分為轉錄起始(initiation)、暫停(pausing)、延伸(elongation)和終止(termination)四個步驟,每個步驟都涉及到RNA聚合酶II(Pol II)與對應的轉錄起始因子、延伸因子或終止因子之間的相互作用和調控。
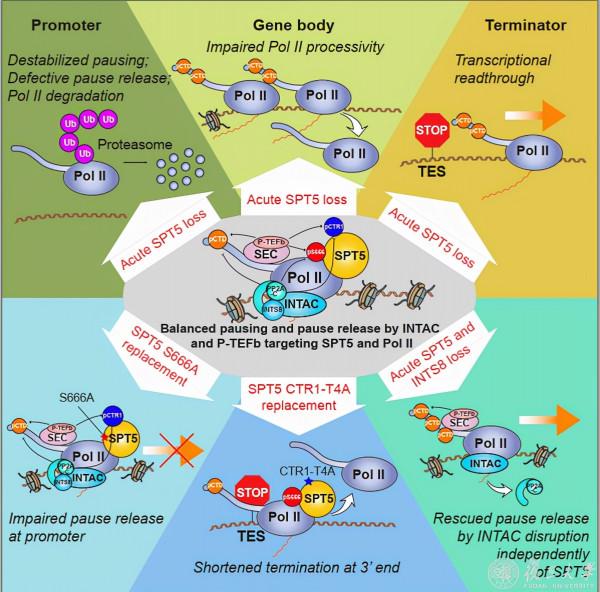
轉錄延伸因子SPT5(細菌的同源蛋白為NusG/RfaH)是唯一在所有生物中都保守的轉錄調節因子。NusG/RfaH在細菌的轉錄和翻譯的偶連中起到了重要作用,在真核生物中SPT5會與SPT4形成DSIF複合物來調控Pol II轉錄的延伸(transcription elongation)。有趣的是,SPT5在多細胞生物中又演化出調控啟動子近端Pol II暫停(promoter-proximal Pol II pausing)的功能。
Pol II在轉錄起始後延伸到20-100 bp後暫停的現象被稱為啟動子近端Pol II暫停,這是轉錄調控的核心;該區域的穩定主要依賴於negative elongation factor (NELF),DRB sensitivity-inducing factor (DSIF)和Pol II-associated factor 1 (PAF1)等複合物來維持。暫停的Pol II在暫停之後,會在“有效的轉錄延伸(productive release)”和“早期終止 (early termination)”兩種命運之間進行選擇。當激酶複合物p-TEFb被招募到pausing位點後,它能磷酸化Pol II CTD、DSIF和NELF,使得NELF解離;隨後暫停的Pol II被轉錄延伸因子DSIF等啟用,從而進入高效的轉錄延伸階段(productive elongation)。
激酶p-TEFb可介導SPT5的第666位點絲氨酸S666和CTR1-T806的磷酸化,而Integrator-PP2A (INTAC)可能做為SPT5的磷酸酶。激酶和磷酸酶如何拮抗SPT5的磷酸化狀態以及如何精確調控核心的轉錄機器仍有待研究。
9月16日,復旦大學生物醫學研究院/附屬腫瘤醫院陳飛課題組在《分子細胞》(Molecular Cell)雜誌上線上發表題為《SPT5可穩定RNA聚合酶II、協調轉錄再迴圈並維持增強子活性》“SPT5 stabilizes RNA polymerase II, orchestrates transcription cycles, and maintains the enhancer landscape”的研究論文。該項研究利用誘導型蛋白降解系統dTAG並結合轉錄調控高通量研究方法,發現轉錄調控因子SPT5能夠直接促進轉錄機器的蛋白質穩定性;在轉錄層面,SPT5能夠調控增強子(enhancer)活性,穩定暫停的Pol II,並促進暫停Pol II的釋放、轉錄延伸和轉錄終止。其中,SPT5第666位的絲氨酸(S666)的磷酸化特異性促進暫停Pol II的釋放,而CTR1的磷酸化特異性調控轉錄終止。同時,這兩個位點均能被磷酸酶INTAC去磷酸化,說明了SPT5介導的INTAC的功能。
ROTACs由靶蛋白配體、E3泛素連線酶配體和連線鏈三部分組成,該分子能分別識別靶蛋白和E3泛素連線酶來誘導靶蛋白的多聚泛素化,從而使靶蛋白能夠被蛋白酶體識別並降解。dTAG是一種能將CRBN泛素連線酶和FKBP12F36V連線起來的新化合物,該系統只要將FKBP12F36V與目標蛋白融合就能實現對其快速且特異的降解。
為了研究SPT5蛋白對基因轉錄直接的調控作用,該研究利用CRISPR-Cas9系統構建了FKBP12F36V-SPT5(SPT5-dTAG)細胞系,從而可以對內源SPT5蛋白進行動態調控。比較意外的是,隨著SPT5蛋白的降解,RNA 聚合酶II最大的亞基RPB1蛋白也隨之減少,並且RPB1 pSer5(與啟動子暫停pausing相關)減少的量比RPB1 pSer2(與轉錄延伸相關)的大;用ChIP-Rx也驗證了這一結果,說明細胞水平和染色質水平上的RPB1均減少。進一步研究發現RPB1蛋白的減少是透過泛素化降解途徑進行的。
PRO-seq (Precision nuclear run-on sequencing)技術是以單個鹼基的解析度檢測轉錄Pol II的定位和轉錄活性的高精度轉錄調控研究方法。利用PRO-seq技術分析SPT5蛋白快速降解的細胞系,團隊發現,基因啟動子暫停的Pol II急劇減少,基本沒看到pause release的想象;轉錄的持續性(processivity)顯著降低;在基因轉錄終止的區域有明顯的轉錄 “順讀”(transcription readthrough)。這些結果說明SPT5在維持暫停Pol II蛋白的穩定性、轉錄延伸和轉錄終止等方面有重要的調控作用。
增強子(enhancer)能透過在時空上精確的調控靶基因的表達。它的轉錄也依賴於Pol II,基於上述SPT5蛋白對mRNA基因轉錄的調控作用,促使研究人員去探究其對增強子轉錄活性的影響。透過ATAC-seq 分析發現 SPT5蛋白的缺失造成了約25%的增強子染色質的可及性(chromatin accessibility)顯著下降。透過H3K27ac,MED1和BRG1(染色質重塑複合物BAF的催化亞基)的ChIP-Rx分析,它們在增強子上的訊號也減弱。以上結果說明SPT5也能調控增強子的轉錄活性。
SPT5做為最保守的轉錄調節因子,激酶p-TEFb能催化SPT5 S666和CTR1位點的磷酸化。為了回答這兩個修飾的對轉錄的調控作用,研究人員分別用這兩個突變位點的SPT5蛋白(SPT5 S666A,SPT5 CTR1-T4A)做了回補實驗。發現SPT5 S666A會使啟動子區暫停Pol II(pausing)訊號增強而基因內部Pol II訊號減弱,提示SPT5 S666的磷酸化可能跟Pol II的釋放(release)有關;SPT5 CTR1-T4A則讓基因轉錄終止訊號提前,說明SPT5 CTR1磷酸化與轉錄終止相關。有意思的是,這兩個位點的磷酸化均能被磷酸酶INTAC去除,提示INTAC在轉錄暫停和轉錄終止這兩個階段發揮著重要的作用。
綜上所述,SPT5蛋白分別從影響增強子的轉錄活性、Pol II蛋白的穩定性、轉錄暫停(pausing)、延伸(elongation)和終止(termination)等方面來調控轉錄核心機器的運轉,為將來研究其生理病理的功能提供理論指導。
據悉,復旦大學附屬腫瘤醫院助理研究員胡士斌、博士後彭林娜和徐從玲為本文共同第一作者,博士生王振寧和宋愛霞對本文也有重要的貢獻,陳飛研究員為本文的通訊作者。TT-seq實驗得到武漢大學梁凱威教授和王紅紅同學的幫助。
值得一提的是,近日美國西北大學Ali Shilatifard課題組在《分子細胞》(Molecular Cell)雜誌上線上發表題為“SPT5 stabilization of promoter-proximal RNA polymerase II”的研究論文。該研究解析了SPT5蛋白缺失後RPB1蛋白的降解機制,發現E3泛素連線酶CUL3和解摺疊酶VCP是必需的。該研究與陳飛團隊第一部分的發現一致。
論文連結:https://doi.org/10.1016/j.molcel.2021.08.029
來 源 生物醫學研究院
編 輯 徐佳徽