導讀:在胃癌患者中,大約五分之一具有HER2陽性。對於HER2陽性的晚期或轉移性胃癌,聯合化療加曲妥珠單抗(一種抗HER2藥物)是一線治療方案,該方案在加入化療後可改善生存結果。但採用該方案進行初始治療後進展的轉移性患者治療方案有限,沒有其他針對HER2的藥物可用。而Enhertu是近年才獲批的一款針對HER2的抗體偶聯藥物(ADC)。
昨日,阿斯利康(AstraZeneca)與第一三共製藥(Daiichi Sankyo)聯合公佈了Enhertu(trastuzumab deruxtecan)治療HER2+ 胃癌/GEJ 癌的研究新資料,在DESTINY-Gastric02 II期試驗中,Enhertu在HER2陽性晚期胃癌患者中顯示了具有臨床意義的持久應答。該研究結果已在2021年歐洲醫學腫瘤學會(ESMO)大會上的最新研究小型口頭報告中公佈。
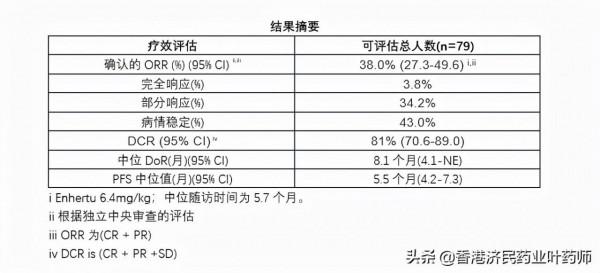
DESTINY-Gastric02是一項全球性、開放標籤、單臂、II期試驗,旨在評估Enhertu(6.4mg/kg)治療HER2陽性轉移性和/或不可切除胃或GEJ腺癌患者的安全性和療效,這些患者在含曲妥珠單抗(trastuzumab)的治療方案當日或之後出現疾病進展。試驗在北美和歐洲的多個地點招募了79名患者。
該試驗的初步分析中,Enhertu的第一項試驗專門針對HER2陽性轉移性胃癌或GEJ腺癌的西方患者,根據獨立中心審查(ICR)評估,Enhertu (6.4 mg/kg)證實總緩解率(ORR)為38%。在Enhertu治療的患者中觀察到3例(3.8%)完全緩解和27例(34.2%)部分緩解。
這些結果與之前在新英格蘭醫學雜誌上發表的註冊DESTINY-Gastric01 II期試驗結果一致。
中位隨訪5.7個月後,Enhertu的中位反應持續時間(DoR)為8.1個月(95%CI 4.1-NE)。中位無進展生存期(PFS)為5.5個月(95%CI 4.2-7.3)。觀察到確診疾病控制率(DCR)為81%(95%CI;70.6-89.0)的探索性終點。
Enhertu 在 DESTINY-Gastric02 中的總體安全性與在 DESTINY-Gastric01 中看到的一致。 DESTINY-Gastric02 中最常見的 3 級或更高級別的藥物相關治療緊急不良事件是貧血 (7.6%)、中性粒細胞減少 (7.6%)、噁心 (3.8%) 和疲勞 (3.8%)。
據獨立裁決委員會確定,有6例(7.6%)治療相關間質性肺病(ILD)或肺炎報告。大多數(83%)為低級別(1級或2級),1例為5級(ILD或肺炎相關死亡)。
Enhertu(trastuzumab deruxtecan)
Enhertu由一種HER2單克隆抗體組成,透過一個穩定的基於四肽的可切割接頭與拓撲異構酶I抑制劑有效載荷exatecan衍生物相連。根據DESTINY-Gastric01試驗的結果,Enhertu在以色列、日本和美國被批准用於治療區域性晚期或轉移性HER2陽性胃或胃食管交界腺癌的成人患者,這些患者先前接受了基於trastuzumab的方案。
當前,Enhertu 正在一項綜合臨床開發計劃中進行進一步評估,以評估多種 HER2靶向癌症的療效和安全性,包括乳腺癌、胃癌、肺癌和結直腸癌。
在2021年ESMO大會期間,多場專題演講將展示Enhertu資料在多種腫瘤型別(包括胃癌、肺癌和乳腺癌)中的強度和深度,增強該藥物在HER2靶向癌症治療中的轉化潛力。
注:本文旨在介紹醫藥健康研究,不作任何用藥依據,具體用藥指引,請諮詢主治醫師。