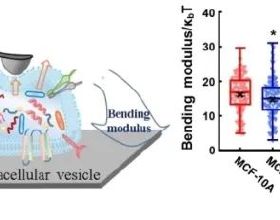
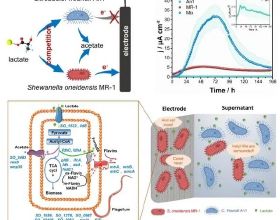
肥胖進展過程中脂肪組織和肝臟會發生慢性亞急性炎症反應,從而導致胰島素抵抗並對全身代謝產生重要影響。腸粘膜屏障受損是肥胖人群的特徵之一【1】,腸道微生物分泌胞外囊泡 (Extracellular vesicle,EV ) 首先透過受損的粘膜屏障,然後避開肝臟的清除作用,將其代謝產物(尤其是細菌DNA)運送到全身各個器官【2】。
胞外囊泡是由細胞分泌的包含雙層膜結構的囊泡狀小體,細菌分泌的胞外囊泡及其攜帶的代謝產物在細菌和宿主之間的交流中起著重要作用,這些生物學效應很大程度上依賴胞外囊泡中所攜帶的細菌DNA。然而,腸道菌群來源的胞外囊泡是否參與肥胖引起的組織炎症和胰島素抵抗目前仍不清楚。
肝臟從血液中清除腸道菌群代謝產物的能力主要歸因於枯否細胞的吞噬作用,研究表明大部分枯否細胞表面表達免疫球蛋白超家族的補體受體(complement receptor of the immunoglobulin superfamily,CRIg),而CRIg的表達對於枯否細胞有效結合和吞噬細菌產物至關重要【3】。然而, 在肥胖的情況下,CRIg 陽性枯否細胞在清除血液中微生物來源EV的作用尚不清楚。
近日,來自加州大學聖地亞哥分校的Wei Ying(通訊作者),聯合華中科技大學同濟醫院的雒真龍(第一作者)在Gastroenterology上發表了題為CRIg+macrophages prevent gut microbial DNA-containing extracellular vesicle induced tissue inflammation and insulin resistance的研究文章,揭示了含有腸道微生物DNA的EV可以穿透肥胖患者受損的腸道屏障;CRIg陽性枯否細胞有助於肝臟清除含腸道微生物DNA的EV,而肥胖導致CRIg陽性枯否細胞數量減少,進而促進含微生物DNA的EV向各種代謝組織的傳播,加劇組織炎症和代謝紊亂。
首先,研究者發現肥胖人群的肝臟、骨骼肌和脂肪組織等多種代謝組織中積累了較多的微生物DNA,提示微生物DNA從腸道洩漏到宿主體內。之前有研究表明,與正常飲食的老鼠相比,飼餵高脂飲食老鼠的血液和組織中微生物DNA的水平更高。然而,這些微生物的DNA是如何運輸到腸道外的仍然存在爭議。在此研究中,研究者發現,在人和小鼠的血漿樣本中,大多數微生物DNA富集於迴圈EV中,這是由於腸道含有微生物DNA的EV的洩漏到宿主體內所致。
除了完整的腸道屏障外,肝臟也是一個重要的血液過濾器官,可以防止微生物產物擴散到遠處的器官。研究人員發現CRIg陽性枯否細胞在阻止含微生物DNA的腸道菌群EV侵入代謝組織中發揮關鍵作用。值得注意的是,長期肥胖可以減少人和小鼠肝臟中的CRIg陽性枯否細胞的數量。因此,肥胖導致的CRIg陽性細胞的丟失使得微生物DNA /腸道EV進入宿主代謝組織。細菌DNA是引起宿主炎症反應的致病分子。該研究揭示了腸道微生物EV滲漏後微生物DNA誘導組織炎症和代謝紊亂的新機制。Ortiz等也報道了微生物DNA的易位可能參與病態肥胖患者的炎症反應和胰島素抵抗。
此研究發現,當胰島素敏感的CRIg 基因敲除小鼠用肥胖小鼠的腸道菌群EV干預時,它們表現為顯著的組織炎症,並伴有胰島素抵抗。相比之下,肥胖小鼠的腸道菌群EV干預對野生型小鼠的代謝影響極小。體外實驗表明,肥胖小鼠腸道菌群EV直接引發細胞炎症反應,降低脂肪細胞和肝細胞的胰島素訊號轉導。然而,微生物DNA的缺失阻礙了肥胖小鼠的腸道菌群EV調節宿主組織炎症和代謝反應的能力。該研究還證明了肥胖小鼠的腸道菌群EV傳遞微生物DNA激活了cGAS/ sting介導的炎症訊號,而cGAS的基因敲除減弱了細胞對微生物DNA富集的反應。
綜上所述,該研究發現含有微生物DNA的腸道菌群EV可以穿透肥胖患者受損的腸道屏障,加劇組織炎症和代謝紊亂。CRIg陽性枯否細胞有助於肝臟過濾含微生物DNA的腸道菌群EV,而肥胖導致CRIg陽性枯否細胞數量減少,進而促進含微生物DNA的腸道菌群EV向各種代謝組織的傳播,進而加劇組織炎症和胰島素抵抗。基於這些研究,該提出了一個新的機制,即滲漏的微生物DNA觸發肥胖組織炎症;CRIg陽性巨噬細胞可以防止微生物含DNA的腸道菌群EV誘導的組織炎症和胰島素抵抗。
本文來自BioArtMED微信公眾號,更多生物領域前沿資訊等你來發現!
轉載須知
【原創文章】BioArtMED原創文章,歡迎個人轉發分享,未經允許禁止轉載,所刊登的所有作品的著作權均為BioArtMED所擁有。BioArtMED保留所有法定權利,違者必究。