瞭解複雜且快速變化的細胞動力學是深入探索生物程序的重要一步。因此,現代生命科學研究越來越需要關注於在分子水平上實時發生的生理事件。
觀察和分析活細胞時面臨的挑戰
在固定細胞或組織中,獲取樣品“分子狀態”的資訊已是一項艱鉅的任務。如果需要獲取實時資訊,,就必須儘可能在實驗過程中保證細胞自然地執行生理機制,因此將加大實驗的困難程度。此外,由於很多生理過程的持續時間僅有幾秒甚至幾毫秒(例如細胞內離子水平的變化),必須在相對較短的時間內採集大量資訊。
滿足這些挑戰性需求的一種方法是採用被統稱為活細胞成像的光學技術。活細胞成像可研究活細胞中的實時動態生理過程,而非提供細胞當前狀態的一幅“快照”。它把快照轉變成了電影。活細胞成像可提供單個細胞、細胞內網路(原位)甚至整個生物體(體內)中動態發生分子事件的空間和時間資訊。這些特性讓活細胞成像成為了研究細胞生物學、癌症、發育生物學和神經科學中動態生理過程的必要技術。
近年來,電子學、光學和生物化學的迅速發展,使得科學家們更輕鬆的實現活細胞成像。如今的活細胞成像方法使用最佳化的顯微鏡、專用光源、高速相機、高靈敏度探測器和特異性的熒游標記物,可同時提供技術成熟且仍具有創新性的全套解決方案,滿足在分子水平上對單細胞或整個細胞網路進行實時研究的挑戰性需求。
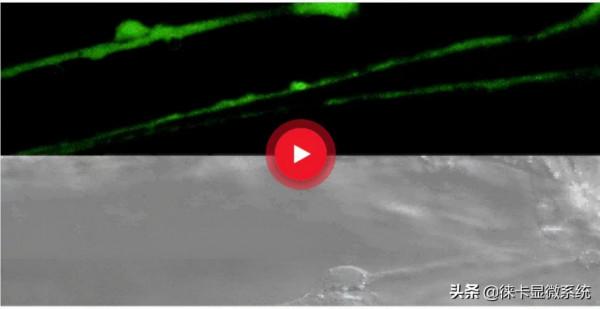
使用線粒體標記物(MitoRed)和熒光鈣染料(Fluo-4)對細胞進行活細胞成像
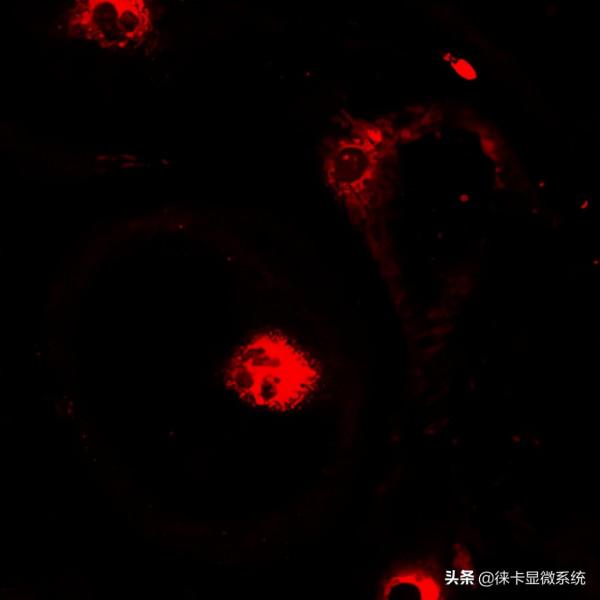
圖1:熒光鈣染料Fluo-4標記的睪丸支援細胞的原代培養。鈣染料的位置類似於表徵細胞內的鈣分佈。
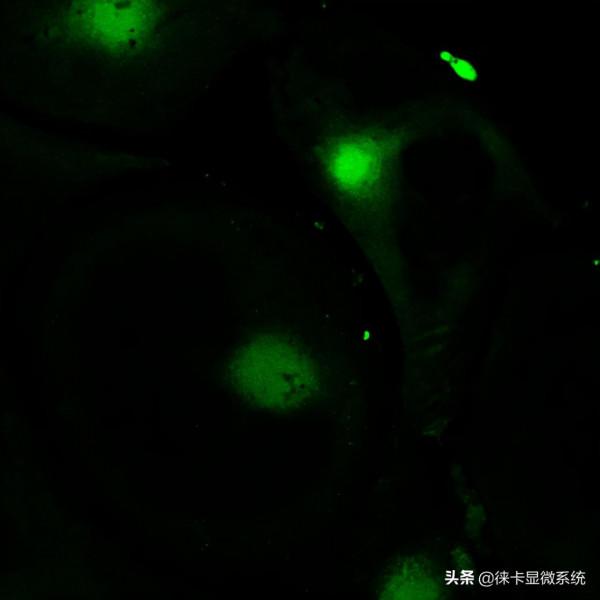
圖2:線粒體標記物MitoRed染色的睪丸支援細胞的原代培養。
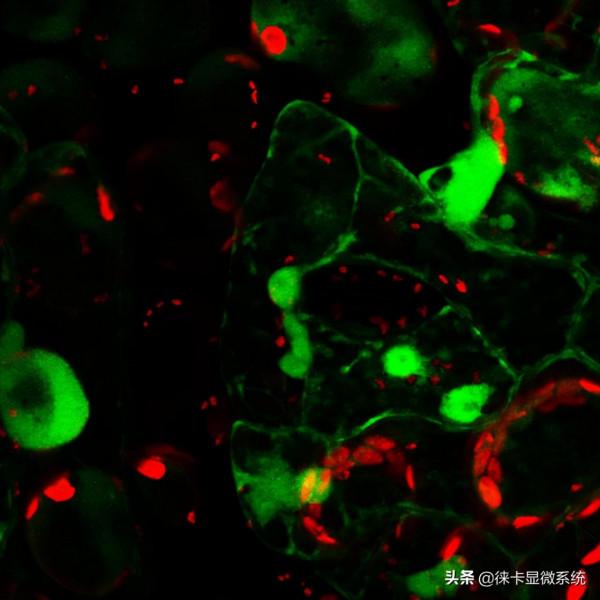
圖3:圖1和圖2的疊加。觀察鈣斑和線粒體的共定位情況。
圖4:睪丸支援細胞的DIC影象。
使用共聚焦顯微鏡Leica TCS SP5(DMI6000 CFS)和Leica LAS AF7000成像軟體獲取的影象。由德國亞琛工業大學生物II研究所化學感知系Sophie Veitinger博士提供。(地址:德國馬爾堡菲利普斯大學細胞生物學和細胞病理學研究所)
對應刊物(非圖片來源):
活細胞成像中的常見問題
活細胞成像通常適用於培養的細胞系(例如HEK細胞、HeLa細胞)、原代細胞(例如面板細胞、神經細胞)、急性製備的組織切片(例如腦切片)或整個器官或生物體。因為細胞被帶出其原本“自然”的培養環境並會受到光毒性的影響,所以在實驗過程中的首要任務是保持細胞的健康狀態。
細胞外溶液
不同型別的人工細胞外溶液(林格氏液、人工腦脊液(ACSF))和培養基(例如Leibovitz L-15)用於為細胞提供維持其生理功能所必需離子和其他輔助因子。用於活細胞成像的培養基成分包括從極簡單的“含鹽”溶液(例如林格氏液)到非常複雜的混合物(例如Leibovitz L-15),種類繁多。
但所有溶液都有一個共同點,即都包含pH緩衝液,因為暴露在環境中之後,會顯著改變培養的pH(通常pH 7.2.-7.4)。在很多細胞外溶液中,pH緩衝液透過新增10–20 mM兩性離子有機化學品HEPES(2-[4-(2-羥乙基)哌嗪-1-基]乙磺酸)來實現。但對於很多細胞來說,細胞外溶液不能用HEPES或其他化學緩衝液(例如MOPS、TES),因為培養基中缺乏pH緩衝碳酸氫鹽會對細胞造成傷害。要解決該問題,必須將二氧化碳輸送到細胞外溶液中(二氧化碳與細胞外溶液接觸時,會轉化為碳酸氫鹽)。這可以透過兩種方式實現:一種是不斷輸送氣態二氧化碳(通常以碳化物的形式:95%的氧氣和5%的二氧化碳)到細胞外溶液中,並不斷對細胞進行換液。這種方法通常用於代謝週轉率高於細胞增殖的切片製備。
另一種常見的方法是將細胞儲存在可調節培養環境氣體濃度和溫度(在很多情況下)的培養室中。在此類培養物中持續供應5-7%的二氧化碳氣體,並且可以嚴格控制溫度。必須根據使用的樣品型別和實驗的持續時間,來確定化學緩衝的細胞外溶液是否足以使細胞保持良好狀態,或者是否需要輸送二氧化碳甚至使用培養小室。在很多情況下,化學緩衝溶液即可滿足細胞培養和短時實驗的要求。,因為急性切片代謝週轉率要高得多,通常需要足夠的二氧化碳供應。但對於很多細胞型別和長時間成像實驗,必須使用培養小室。
光毒性
使用熒光染料進行活細胞成像的另一個問題是:鐳射或高強度電弧放電燈的入射光會損害細胞,即所謂的光毒性。光毒性主要在合成熒光染料被激發時發生。熒光染料被激發後,它們將與分子氧發生反應併產生自由基。為避免光毒性,必須選擇儘可能低的光強度和儘可能短的激發持續時間,以將入射高能光劑量保持在儘可能低的水平。在實驗設計過程中,還必須考慮實驗的持續時間。長時間實驗中,通常不需要高幀速率。因此,影象採集的週期頻率通常可以從例如每秒10多幀降低到每秒1幀甚至更低。這將顯著降低樣品上的入射光劑量,從而大幅降低光毒性。
對於低強度熒光訊號成像,可以考慮更改影象採集條件設定,比如在大多數情況下,透過將相機功能用作畫素合併或提高增益,甚至使用特殊的高靈敏度相機(例如EM-CCD相機)進行成像。這樣可以在不增加激發持續時間或光強度的情況下實現更好的信噪比和訊號質量,而這兩者都會導致更高的光毒性。此外,選擇具有長激發波長的熒光基團也可降低光毒性,因為與具有短激發波長的熒光基團相比,傳遞給樣品的能量更低。熒光蛋白(例如綠色熒光蛋白(GFP))的光敏位點位於被多肽包膜覆蓋的蛋白質內部,因此通常沒有光毒性。
焦面漂移
此外,在長時間的活細胞成像實驗中,很可能發生焦面漂移的問題,,。可以使用配備有軟體或硬體控制自動對焦的成像儀器來避免這種情況。
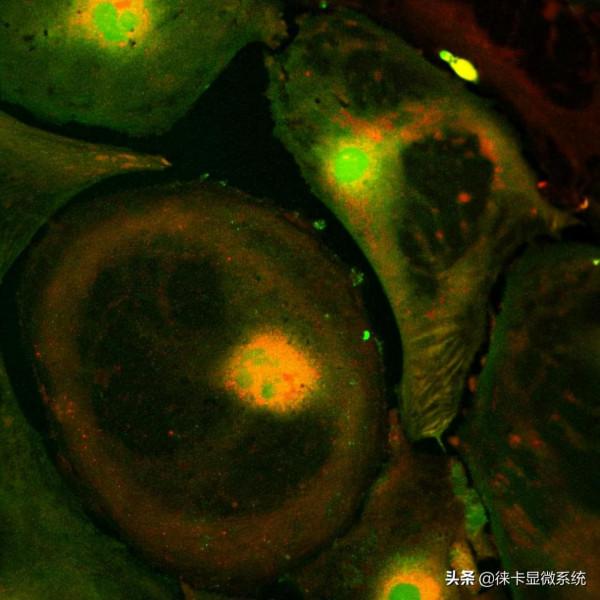
圖5:接種了豇豆花葉病毒(CPMV)的豇豆初生葉(Vigna unguiculata "California Blackeye"),在病毒RNA 2中的運動蛋白(MP)和衣殼蛋白(CP)之間的插入GFP基因。GFP以遊離蛋白的形式大量表達(因此未融合於MP或CP),並且可以定位在受感染的表皮和葉肉細胞的細胞質和細胞核中。由荷蘭瓦赫寧根農業大學,生物分子科學部門分子生物學實驗室的Joan Wellink博士及植物科學部門病毒學實驗室的Jan van Lent博士提供。
影片1:用DIOC6染色的活洋蔥球細胞,同時進行透射光檢測;使用共聚焦顯微鏡Leica TCS SP2 AOBS RS拍攝,63倍物鏡,1.5倍變焦,2倍線平均,掃描解析度512 x 265,速度每秒4.7幀。
影片2:用表達GFP融合蛋白的構建體瞬時轉染的COS細胞。細胞溶質蛋白在細胞中呈針狀分佈。3D堆疊(10.14 µm,14層切)每5秒記錄一次,,持續10分鐘。本影片使用了堆疊的最大投影。512 x 512畫素,雙向掃描,變焦2倍,物鏡HCX APO L U-V-I 63.0 x 0.90 W UV。由法國伊爾基希細胞生物學研究所成像中心Jocelyn Laporte,提供。
用於活細胞成像的方法
可應用於活細胞成像的寬場和共聚焦顯微技術的範圍也非常廣泛。通常,使用複式顯微鏡和反差對比方法(例如相差和微分干涉相差(DIC)),隨時間觀察細胞的生長、聚集或運動過程。此外,通常使用體視顯微鏡或宏觀鏡對大型標本(例如發育中的斑馬魚胚胎)進行延時成像。在過去數十年中,先進熒光技術變得越來越重要。共聚焦顯微鏡應用的迅速增加,使生物研究的視角從平面向三維立體轉變。
閱讀有關活細胞成像技術的更多資訊
活細胞成像技術——觀察生命的分子水平動態
相關連結:細胞生物學、 細胞培養、活細胞成像、類器官和3D細胞培養