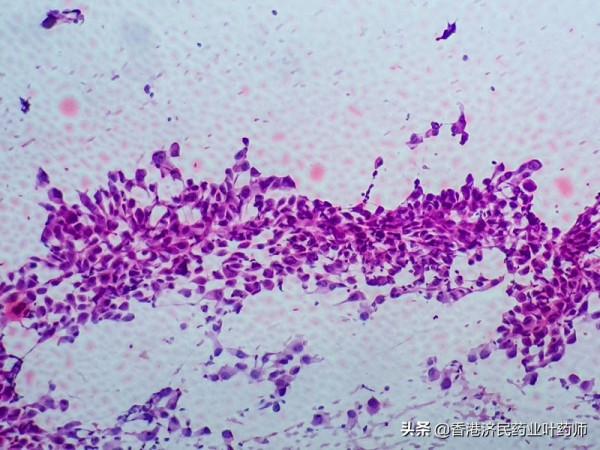
默克公司(Merck)12月17日宣佈,歐洲藥品管理局(EMA)的人類用藥產品委員會(CHMP)通過了一項積極意見,建議批准每日一次口服TEPMETKO(tepotinib,中文譯名:特泊替尼)作為單一療法,用於治療患有在接受免疫治療和/或鉑類化療之前需要進行全身治療,且具有導致間質上皮轉化因子基因第14外顯子(METex14)跳躍改變的晚期非小細胞肺癌(NSCLC)的成人患者。
歐洲委員會(EC)現在將對CHMP的肯定意見進行審查,預計將在2022年第一季度做出決定。
“TEPMETKO 已證明在治療這種侵襲性肺癌方面具有重要的臨床益處和可控的安全性,並有可能推進這種型別的腫瘤的治療,” 默克的醫療保健業務部門全球開發負責人Danny Bar-Zohar 醫學博士表示,“我們期待歐盟委員會的決定,並向歐洲患者提供第一種非小細胞肺癌口服MET抑制劑。”
積極的意見是基於一項正在進行的關鍵II期、多中心、多佇列、單臂、非隨機、開放標籤研究VISION (NCT02864992),該研究納入275例中位年齡為72.6歲的晚期或轉移性NSCLC伴METex14跳躍性改變的患者,進行每日一次口服TEPMETKO單藥治療。
VISION 研究的主要分析資料先前發表在《新英格蘭醫學雜誌》上,表明 TEPMETKO 在未經治療和先前接受過治療的晚期 NSCLC 成年患者中均表現出一致和持久的反應,這些患者具有導致 METex14 跳躍的改變。
在IASLC 2021年世界肺癌大會上介紹的VISION研究的其他資料包括佇列C中123例患者的結果,這些患者從治療開始後接受了至少3個月的隨訪,並提供了額外的證據來支援初步分析中顯示的具有臨床意義的應答。
在歐洲,肺癌估計是第二大常見癌症,也是癌症相關死亡的主要原因,2018年有388000人死於肺癌。在3%至4%的NSCLC病例中發現了MET訊號通路的改變,包括METex14跳過改變,並且與疾病晚期和預後不良相關。
TEPMETKO 是一種口服 MET 抑制劑,可抑制由 MET(基因)改變引起的致癌 MET 受體訊號,具有高度選擇性的作用機制,有可能改善預後不良並具有這些特定改變的侵襲性腫瘤的結果。
目前,默克公司還在研究tepotinib在治療MET擴增引起的非小細胞肺癌和獲得性耐藥患者中的潛在作用。在II期INSIGHT 2研究中,tepotinib與奧希替尼聯合治療在接受奧希替尼一線治療後進展且攜帶活化EGFR突變的MET擴增、晚期或轉移性非小細胞肺癌。
該藥是世界上第一個獲得監管批准的口服 MET 抑制劑,用於治療攜帶 MET 基因改變的晚期非小細胞肺癌,並於 2020 年 3 月在日本獲得批准。
2021 年 2 月,美國食品和藥物管理局加速批准TEPMETKO用於治療攜帶 MET 基因改變的晚期非小細胞肺癌,使其成為第一個也是唯一一個被批准用於美國具有 METex14 跳躍改變的轉移性非小細胞肺癌患者的每日一次口服 MET 抑制劑。該適應症的加速批准基於總體反應率和反應持續時間。對該適應症的持續批准可能取決於驗證性試驗中對臨床益處的驗證和描述。
Tepotinib可在許多國家/地區使用,並正在接受全球其他各種監管機構的審查。為滿足迫切的臨床需求,根據政府推動在中國境外批准的創新藥物的早期准入的政策,tepotinib也在中國的試驗區上市。
參考來源:TEPMETKO (tepotinib) Receives Positive CHMP Opinion for Patients with Advanced NSCLC with METex14 Skipping Alterations
注:以上資訊整理自網路,旨在幫助患者瞭解國際新藥動態,不作任何用藥依據,具體用藥指引請諮詢主治醫師。