2021年美國血液學會(ASH)年會於美國時間12月11日起正式開幕,大會內容緊湊,類目繁多,醫學界血液頻道緊密跟蹤大會動態,優中選優,持續播報精彩內容,為廣大臨床醫生送達前沿學術思想,更新治療策略!
WBRT or ASCT?
這是個問題!
根據先前彙報的,PRECIS研究的中位時間為33個月的隨訪結果顯示,全腦放療(WBRT)和自體造血幹細胞移植(ASCT)均可對患者進行有效治療,但WBRT組患者複發率更高。WBRT組與ASCT組患者經鞏固治療後的2年無事件生存(EFS)率分別為69%(95%CI 57%-83%)和87%(95%CI 77%-98%,P=0.03),而兩組患者的總生存期(OS)相似。
WBRT組患者經治療後可觀察到出現認知障礙,而ASCT患者治療後認知功能得以更多的保留或改善。此次彙報更新了研究中位隨訪98.3個月後的最新資料,以評估不同治療方法對患者復發、生存和晚期併發症的影響。
圖1:Caroline Houillie教授ASH 2021口頭彙報封面
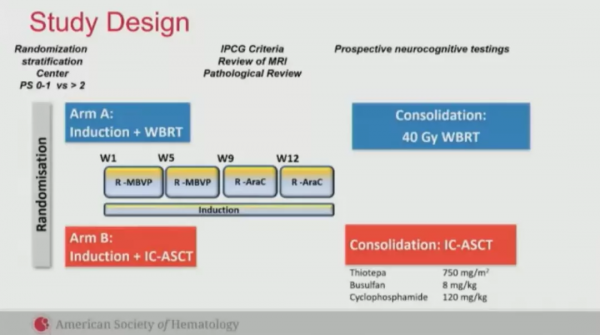
研究將140例免疫功能正常的未經治療的原發性中樞神經系統淋巴瘤(PCNSL)患者隨機分為A組(n=70)與B組(n=70),在接受兩個周R-MBVP(利妥昔單抗、甲氨蝶呤、VP16、BCNU、強的松)與兩個週期R-AraC(利妥昔單抗、阿糖胞苷)的誘導化療後,分別接受WBRT(40Gy,2 Gy/次)或ASCT進行鞏固治療,預處理方案為噻替哌[750mg/(m^2·d)]+白舒非(8mg/kg)+環磷醯胺(60mg/kg)。
圖2:研究設計
對患者認知功能的評估將持續至患者出現病情進展(PD),並對患者整體認知功能、情景語言記憶力、注意力和思維靈活性以及心理情感狀態進行重點評估。
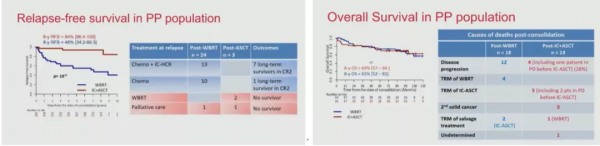
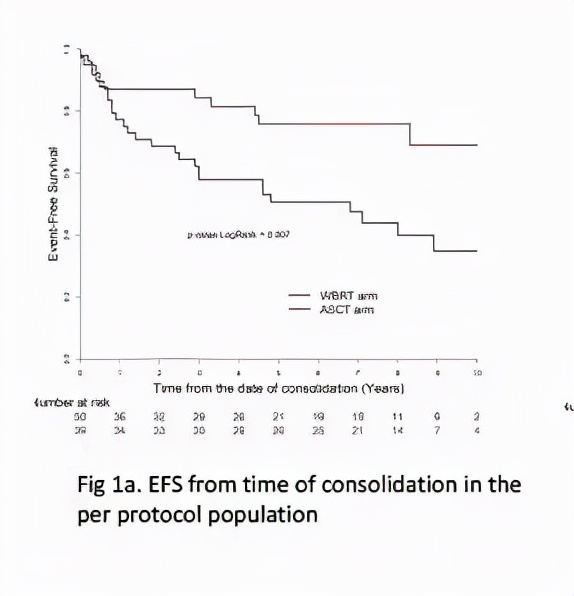
結果顯示,A、B兩組分別有53例與44例患者完成了WBRT或ASCT治療,其中A組有3例患者,B組有5例患者在接受WBRT或ASCT治療時處於PD的狀態。兩組患者在接受鞏固治療後的8年EFS率分別為75.9%(3.3%-91.0%)和39.9%(6.8%-59.3%,P=0.007)。
與A組患者相比,B組患者治療後復發風險顯著降低,8年無復發間隔(RFS)率分別為94.1%(86.4%-100%)vs 47.6%(34.2%-66.3%),兩組患者8年OS率相似,分別為63.4%(49.8%-80.6%)和69.3%(56.7%-84.8%)。24例接受WBRT後復發的患者中,有13例患者隨後接受了挽救性化療和鞏固性ASCT,其中7例患者在最後一次隨訪時無病。
圖3:兩組患者8年RFS率與OS率資料
A組17例WBRT後死亡的患者中,有12例患者因PD死亡、3例患者因神經毒性死亡、2例因2線ASCT治療死亡;B組14例ASCT後死亡的患者中,有5例患者因ASCT治療相關原因死亡(2例死亡時間在ASCT治療100天后,2例在ASCT治療治療前出現PD)、4例患者因PD死亡、1例患者因挽救WBRT的神經毒性死亡、3例患者因其他腫瘤死亡還有一例患者未明確死因。
圖4:患者EFS評分
在多變數分析中,患者的美國東部腫瘤協作組體能狀態(ECOG)評分、誘導化療結束時患者的疾病狀態以及患者確診時腦脊液蛋白質水平是預測患者OS的獨立預測因素。誘導化療結束時,患者的疾病狀態以及確診時患者眼部受累情況是預測患者EFS的獨立預測因素。僅在接受WBRT的患者中觀察到可能致命的認知能力下降,鞏固治療後腦白質疾病病的影像學分析目前仍在進行中。
研究結果表明,患者經基於大劑量甲氨蝶呤(HD-MTX)的誘導化療後,採用ASCT進行鞏固有較好疾病控制,但與WBRT相比,治療相關死亡率更高。患者經WBRT鞏固治療後,可觀察到嚴重的認知能力下降以及治療引起的相關神經毒性。同時,研究指出應略微降低患者在ASCT鞏固治療前使用的噻替哌+白舒非+環磷醯胺方案的用藥強度,以提高ASCT在年輕PCNSL患者一線治療中的獲益/風險比。
這麼多這治療方案,哪一種
能讓患者既省錢有能獲得好的療效?
對於早期預後不良霍奇金淋巴瘤(HL),有多種一線治療方案。因為可以明顯改善患者無進展生存期(PFS),放療一直是此類患者的主要治療手段,但長期使用放化療方案會產生使患者繼發包括乳腺癌在內等其他腫瘤或心衰的風險。
最近一些關於使用PET指導的治療方案(HD17研究)或結合新藥物[nivolumab AVD(N-AVD)、brentuximab AVD(a-AVD)]治療方案的研究,對傳統放療方案的地位產生了挑戰。但目前,這些治療方案的長期療效仍不確定,同時新療法的治療成本也比較高。
圖5:Abi Vijenthira教授ASH 2021口頭彙報封面
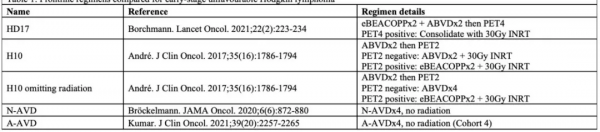
此項研究對五種(HD17研究方案、2種HD10研究方案、N-AVD方案以及無放療A-AVD方案)早期預後不良HL的一線治療方案進行了成本效益和成本效用分析,並使用TreeAge Pro 2021構建了具有生命週期範圍的馬爾可夫模型。
表1:5種方案對比
基礎病例為一名20歲,伴有縱隔腫塊,需要進行胸部野放療的女性患者。模型中的基線估值來自相關文獻研究,包括每一線治療後的復發風險、晚期併發症風險(乳腺癌等繼發性癌症以及心力衰竭)、死亡風險(併發症、淋巴瘤以及死亡率背景資料)和健康狀況等。患者治療費用由加拿大醫保承擔,預計約需2021加元,並採用3%的全球折扣。
圖6:治療方案模型
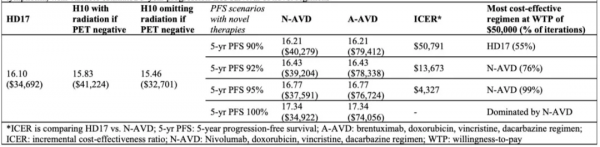
研究進行了10000次機率敏感性模擬分析,首先評估了新治療方案(N-AVD或A-AVD)患者長期PFS的不確定性,在患者預算為50000美元/QALY的情況下,5年PFS率在不低於92%的情況下,N-AVD方案是最具成本效益的治療方案。若5年PFS率低於92%,則HD17研究方案將成為最具成本效益的治療方案。在不設PFS閾值的情況下,A-AVD方案則將成為最具成本效益的治療方案。
在將5年PFS率閾值設定為92%時,該研究模型依然可對多種確定性敏感性因素進行分析測試,測試變數包括健康狀況效用(移植治療後復發、乳腺癌等繼發第二惡性腫瘤、心力衰竭)、治療成本(放療、自體幹細胞移植、乳腺癌等繼發第二惡性腫瘤、心力衰竭)以及風險(放療引發乳腺癌、放化療後引發心血管疾病)等。
結果顯示,若患者採用HD17研究方案5年後引發第二惡性腫瘤的風險小於2%[HD17研究結果顯示,治療後48個月引發第二惡性腫瘤的風險為1%。HD14研究(治療方案與HD17研究方案相似)結果顯示,治療後43個月引發第二惡性腫瘤的風險為2%],患者繼發第二惡性腫瘤後,中位OS超過9年,HD17研究方案將成為最具成本效益的方案。而由於使用了Brentuximab,A-AVD方案成為了最具成本效益的方案,最低成本為每劑5000美元(依據當前匯率約為14520加元)。
表2:5年PFS結果
研究結果表明,若長期PFS率高於92%,在對早期預後不良HL年輕女性患者進行治療時,N-AVD方案是最具成本效益的治療方案。然而由於目前僅僅發表了一項非隨機Ⅱ期研究的短期隨訪資料,關於新療法的療效和風險仍存在不確定性。因此,目前HD17研究方案仍然是已釋出的Ⅲ期研究方案中最具成本效益的治療方案,而HD17研究的長期隨訪資料對於瞭解此方案引發患者第二惡性腫瘤的風險也很有意義,並可能影響其成本效益。