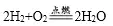上課影片(點選連結播放)
一、為什麼要電解水?
因為水是生命之源,是我們最常見的物質,人們就喜歡研究它,想看看它有什麼組成的。
二、誰第一個想到電解水?
電解水的先驅者—尼科爾森
W.William Nicholson (1753~1815)英國化學家。1753年生於倫敦,1815年5月21日卒於倫敦。曾任朴茨茅斯自來水廠工程師。尼科爾森1790年發明了自來水錶(尼科爾森水錶)和印刷亞麻布的機器。其最重要的貢獻為最早進行電化學反應。1800年他得知發明了伏打電池後,同年5月2日同解剖學家A.卡萊爾用銀幣和鋅片各36枚重疊起來製成電池。他們發現,當將兩根分別連線銀幣和鋅片的導線放在水中時,與鋅(負極)連線的金屬絲上發生氫氣泡,而與銀(正極)連線的金屬絲上產生氧氣。這樣,他們成為電解水的先驅者。1797年他創辦了《自然哲學、化學和技術》雜誌。著有《自然哲學導論》(1781)和《理論與應用化學字典》(1808)。
三、電化學簡史
目前,電池的發展歷史在當代的應用可謂是越來越廣泛,電池的發展歷史是值得我們好好學習的,現在我們就深入瞭解電池的發展歷史。
1771年,義大利生理學家、解剖學家伽伐尼(Luigi Galvani,1737~1798)發現蛙腿肌肉接觸金屬刀片時候會發生痙攣。他於1791年發表了實驗結果,這標誌著電化學(和電生理學)的誕生。
1799年,義大利物理學家伏特(alessandro volta)把一塊鋅板和一塊銀板浸在鹽水裡,發現有電流透過金屬板間的導線。據此他製成了世界上第一個電池──“伏特電堆”。
1800年,英國化學家安東尼·卡萊爾和威廉·尼科爾森透過電解的方式成功將水分解為氫氣和氧氣。但是最早水的電解實驗由1789年由兩名荷蘭科學家完成的,當時的電力來自摩擦生電。
1805年,義大利化學家Luigi V.Brugnatelli進行了第一次電沉積,電沉積是在外加電流作用下溶液的金屬離子在陰極上還原沉積為金屬,即金屬從其化合物水溶液中沉積到陰極表面。這個發現奠定了電鍍的理論基礎。
1806年,英國化學家戴維(Humphry Davy,1778~1829)再一次進行了電解水實驗。他發現在電解以後,正極的水可以使石蕊試紙變紅,說明產生了酸性物質;而負極可以使石蕊試紙變藍,說明產生了鹼性物質。
1807年,英國化學家戴維用電解氫氧化鉀和氫氧化鈉的方法得到了鉀和鈉金屬單質。隨後,他又製出了鈣、鋇、鎂、鍶等金屬物質。
1832年,英國科學家法拉第(Michael Faraday 1791~1867)基於其電解實驗闡述了法拉第電解定律,這個定律適用於一切電極反應的氧化還原過程,是電化學反應中的基本定量定律。
1836年,英國的約翰·費德里克·丹尼爾改良“伏特電堆”,他將鋅置於硫酸鋅溶液中,將銅置於硫酸銅溶液中,並用鹽橋或離子膜等方法將兩電解質溶液連線的一種原電池。這種電池解決了電池極化問題,使電池電壓趨於穩定。因此這種電池又稱丹尼爾電池。
1837年,俄國的雅可比和英國的司本沙等人在進行原電池實驗時,不約而同地發現了鍍銅現象。
1839年,英國科學家威廉·羅伯特·格羅夫提出出了燃料電池的設計原理,該燃料電池利用氫和氧的化合反應。
1840年,英國人Elkington獲得了氰化鍍銀的第一個專利,並用於工業生產,這是電鍍工業的開始。
1843年,酸性硫酸銅鍍銅用於工業生產。
1843年,德國工程學家西門子(Ernst Werner von Siemens,1816-1892)發明了電鍍鎳技術,對後世印刷技術的發展起了非常重要的作用。
1852年,德國化學家本生(Robert Wilhelm Bunsen,1811~1899)研究金屬的電解制法,最後找到電解熔融金屬氯化物的方法。開始時是由氯化鎂制鎂,接著連續地製出了鈉、鈣、鋇、鋰、鉻和錳等。
1860年,法國的普朗泰(raymond)發明出鉛酸電池。後來這種電池發展成為目前廣泛使用的“鉛酸蓄電池”。
1866年,法國人雷克蘭士發明新電池。它的負極是鋅和汞的合金棒,而它的正極盛裝著碾碎的二氧化錳和碳的混合物。這一電池後來成為世界上第一種被廣泛使用的碳鋅電池。
1866年,德國西門子提出了發電機的工作原理,同年,該公司發明了第一臺直流電動機。電解技術開始大規模應用於工業領域。
1884年,瑞典化學家斯凡特·奧古斯特·阿倫尼烏斯提出了溶質電離理論。1887年,他完善了該理論,並逐步得到了公眾認可。
1886年,法國人保羅·埃魯和美國人查爾斯·霍爾分別獨立的提出了電解氧化鋁製備純鋁的霍爾-埃魯法。
1887年,英國人赫勒森(Wilhelm Hellesen)發明了最早的乾電池,乾電池的電解液為糊狀,不會溢漏,便於攜帶,最後該種電池發展成電池的一大家族。
1888年,德國科學家瓦爾特·能斯特(Walther Hermann Nernst,1864~1941)提出了原電池的電動勢的理論,隨後他提出了能斯特方程。
1890年,美國發明家愛迪生(Thomas Edison)發明可充電的鐵鎳電池。
1894年,德國化學家威廉·奧斯特瓦爾德透過測定有機酸的電導率,進一步證明了阿倫尼烏斯的電離理論。
1898年,德國化學家弗裡茨·哈伯發現電解池中陰極電位決定還原產物的化學組成,同年他解釋了硝基苯的電解還原過程。
1899年,瑞典科學家Waldmar Jungner發明開口型鎳鎘電池。
1914年,美國發明家愛迪生髮明鹼性電池。
1937年,瑞典化學家阿爾內·蒂塞利烏斯(Arne Wilhelm Kaurin Tiselius,1902~1971)製作了第一套精細的電泳裝置。他因對蛋白質電泳的研究獲得1948年諾貝爾化學獎。
1976年,Philips Research的科學家發明鎳氫電池。
1991年,日本Sony公司可充電鋰離子電池商業化生產
1999年,可充電鋰聚合物電池商業化生產
四、初中學科如何做電解水?
1.實驗報告
2.實驗影片
3.考點
水的組成
一、水(H2O)的組成:
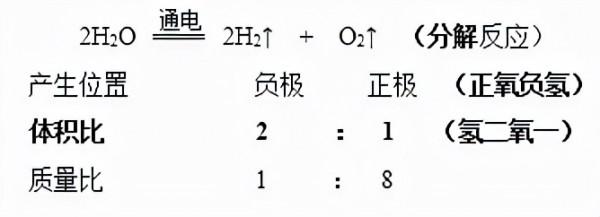
1.電解水的實驗: (加入硫酸或氫氧化鈉的目的----增強水的導電性)
(1)實驗現象:正、負電極上都有氣泡產生,一段時間後正、負兩極所收集氣體的體積比約為1∶2。而且將負極試管所收集的氣體移近火焰時,氣體能燃燒呈淡藍色火焰;用帶火星的木條伸入正極試管中的氣體,能使帶火星的木條復燃。
(2)化學反應
(3)檢驗:
O2---出氣口置一根帶火星的木條----木條復燃
H2---出氣口置一根燃著的木條------氣體燃燒,產生淡藍色的火焰
(4)O2和H2的體積比小於1/2的原因:氧氣相對氫氣更易溶於水;氧氣與電極反應。
(5)實驗結論:
①水是由氫、氧元素組成的。(化學反應前後,原子、元素種類不變);
②水在通電的條件下,發生分解反應產生氫氣和氧氣。
③一個水分子是由2個氫原子和1個氧原子構成的。
④化學變化中,分子可分而原子不可分。
二、 氫氣(H2)
1.物理性質:無色無味的氣體;密度最小的氣體(向下排空氣法);難溶於水(排水法)
2.化學性質:
可燃性:(化合反應)
〔可燃性氣體(如H2、CO)點燃前,要驗純〕
3.現象:發出淡藍色火焰,放出熱量,有無色液滴產生
4.用途:高能燃料;氫氧焰焊接切割金屬,冶煉金屬
三、 物質的分類
基本概念:
單質:由同種元素組成的純淨物叫單質。
化合物:由不同種元素組成的純淨物叫化合物。
氧化物:由兩種元素組成的化合物中,其中一種元素是氧元素的叫做氧化物
4.經典訓練
五、兩個霍夫曼
1.奧格斯特·威廉·馮·霍夫曼
霍夫曼(德國柏林大學教授)_百度百科 (baidu.com)
實驗探究 實驗室鼓搗霍夫曼水電解器_六安市級名師工作室-高俊工作室_新浪部落格
2.費利克斯·霍夫曼