本文由brainnews腦科學世界團隊原創編譯,轉載請聯絡授權。
Greengard遺產: 留給後人新的領域去拓展,科學獎與傳承
縱觀歷史長流,科學的發展是由眾多很小的發現逐漸累積的。但在這所有的發現中,最重要的是那些突破性的、開啟新領域的發現。經濟學上有個說法叫帕累托法則(Pareto principle,俗稱二八法則),即80%的土地為20%富人所有。科學上也有類似的現象,即80%的大文章由20%的精英科學家發表。在諾貝爾獎獲得者中該比例更高。當然,這也會進入一個“富人越來越富”的迴圈。精英科學家獲得更多的資助、招募更優秀的學生、發表更多的文章,這是科學上的馬太效應(Matthew Effect in Science)。
不過,精英科學家之所以成為精英科學家,是因為做出了突破性的發現。通常這類開創新領域的發現是以技術突破為主,比如CRISPR基因編輯技術、光遺傳學等,其次是概念、認識上的突破。Greengard的研究屬於後者,俗稱paradigm-shifting(正規化轉換)的發現。Greengard基本上在每一個方向上的研究都是paradigm-shifting的發現。以磷酸化/去磷酸化化學反應為主的細胞訊號通路介導的“神經傳遞慢反應”,這一Greengard剛建立實驗室時提出的觀念,從最初被同行嘲笑到現在已經寫入教材成為常識性的知識。
神經傳遞慢反應的“慢”是相對神經傳遞快反應而言的。從神經遞質(如穀氨酸)結合離子型受體,通道開啟,離子跨膜傳輸形成電流,細胞電壓變化,整個反應發生在1毫秒之內;而由代謝型受體(比如多巴胺受體)介導的慢反應則耗時幾百毫秒,甚至幾分鐘。但對於化學反應而言,幾百毫秒到幾分鐘的“慢”反應仍然是很“快”的反應,故一開始Greengard的同行都不接受他的觀點。
但Greengard的研究為我們開啟了全新的一個世界,讓我們認識到 這個“慢”的磷酸化/去磷酸化反應下游的多個效應物,包括:
1)離子通道,透過磷酸化修飾改變離子通道傳輸離子的能力,從而影響電導(G,電阻的倒立1/R,通道開啟,電阻下降,電導上升)和動作電位(參考上文);
2)離子泵,在動作電位時,離子順著細胞內外濃度差傳輸之後,需要透過離子泵逆濃度差傳輸回去,恢復濃度差,而對離子泵的磷酸化修飾則可透過改變離子濃度來影響細胞活性;
3)神經遞質受體,包括離子型和代謝型受體(快和慢神經傳遞都受影響),對受體的磷酸化修飾可以一方面直接影響受體活性,另一方面影響受體插入細胞膜和從細胞膜內吞,從而改變受體的多少,兩個影響都可改變突觸的強弱,即突觸可塑性;
4)基因表達,包括對神經遞質受體基因表達的影響,從而影響受體的多少。
在調控突觸可塑性方面,改變受體活性的影響較快,受體的入膜和內吞的影響較慢持續時間較長,受體基因表達的影響最慢持續時間最長。突觸可塑性目前認為是學習和記憶的基礎,Greengard 的好友Eric Kandel在這方面有重大貢獻。總之,基本上這裡提到的每一個研究都是開創一個新的領域。
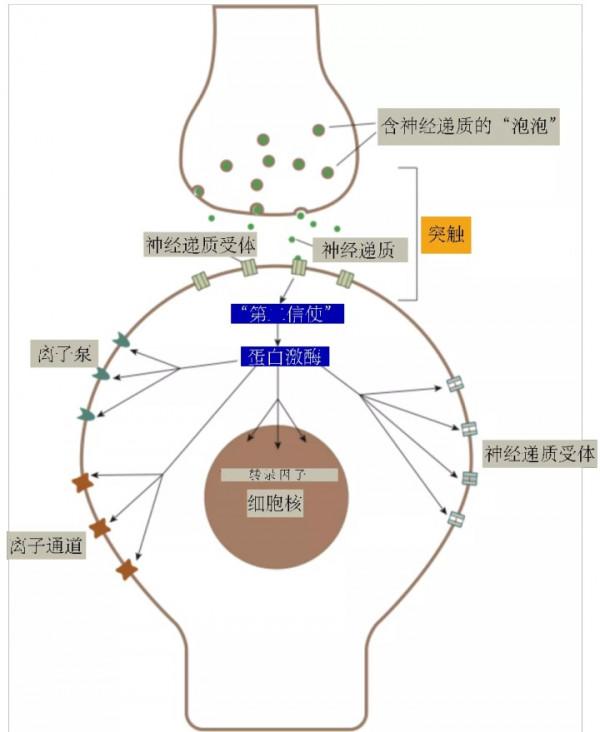
圖22. 神經傳遞慢反應的“第二信使”及下游效應58(作者漢化)。
最終Greengard與發現多巴胺的Carlsson、研究學習和記憶的神經分子機制的Kandel共享了2000年諾貝爾生理學或醫學獎。2004年,Greengard將他的諾獎獎金用於成立Pearl Meister Greengard Prize,紀念他因難產而死的母親。Greengard直到上大學才知道他生母的事情,對於生母Pearl Meister Greengard,他沒有任何記憶、照片和資訊,他希望這個獎能夠證明他母親的存在。
該獎由洛克菲勒大學每年一次頒發給女性生物學家,用來支援女性科學家。獲獎者中已有三人後來獲諾貝爾獎,包括去年因CRISPR技術而獲諾貝爾化學獎的Jennifer Doudna。獲獎者中還有中科大天才班畢業生、著名華人生物物理學家莊小威。今年10月1日,mRNA疫苗技術發明人之一Katalin Karikó也被授予該獎。

圖23. 千禧年諾貝爾生理學或醫學獎的三位得主。(圖片來源自諾獎官網截圖)
Greengard的小兒子Leslie有醫學和計算機科學雙博士學位,兩人曾合作建立多巴胺訊號通路數學模型59。
Greengard還培養了許多優秀的學生,除了上面提到的,還有Eric Nestler,讀博期間主要研究cGMP訊號通路和Synapsin I。據Nestler回憶,第一次去找Greengard的時候,秘書叫他敲門然後直接進去。他進去後,只看到兩隻大哈士奇盯著他,卻不見Greengard。原來Greengard躺在辦公桌後面的地板上看文獻,他背不太好,所以經常是躺地上辦公。Nestler現為紐約西奈山醫學院的學術院長、腦研究所主任。Greengard後來養了只大伯恩山犬,叫Alpha。當有客人來他辦公室的時候,Alpha就會第一個衝過去自我介紹。不熟悉Greengard的人往往會嚇一跳。但Alpha很溫順,從來不亂叫。 Greengard的博後Richard Huganir,主要研究cAMP啟用的激酶透過磷酸化神經遞質受體和離子通道來調控神經細胞活性。在Huganir師從Greengard的第二年,Greengard從耶魯大學搬到了洛克菲勒大學(Rockefeller)。後來Huganir有了兩個孩子,紐約的消費太高,Huganir也想獨立做學習和記憶相關的研究,於是Greengard把他推薦給了Synder。Huganir現任約翰斯·霍普金斯大學Solomon Snyder神經科學系系主任。華人神經科學家中,美國凱斯西儲大學(Case West Reserve University)神經科學系主任梅林、密西根大學葉冰、香港科技大學夏軍、美國國立衛生研究院藥物濫用研究所(NIDA)的Da-Ting Lin等均曾師從Huganir。Nestler和Huganir也都曾先後擔任神經科學學會SfN主席。 Greengard的博士Marina Picciotto,博士期間克隆了CaMKI基因,現為耶魯大學教授,主要研究尼古丁成癮的機制,Picciotto還是神經科學學會會刊The Journal of Neuroscience現主編。Greengard的博後、華人科學家Linda C. Hsieh-Wilson研究磷酸化修飾對肌動蛋白、AMPA受體活性和突觸可塑性的影響,現為加州理工大學(Caltech)教授,研究蛋白糖基化修飾對神經功能的影響。 博後Mary Kennedy研究CaMKII,現在同為加州理工大學教授,主要研究突觸後支架蛋白PSD和突觸可塑性。博後Daniele Piomelli同樣研究CaMKII,現在為內源性大麻素研究領域的領袖。Greengard還培養了很多優秀的科學家,不再一一介紹。 2019年4月13日,Greengard去世,享年93歲。Greengard將一生都奉獻給了科研,他沒有擔任任何系主任、院長等職務,他認為行政工作會影響他對科研的投入(顯然,他的兩個弟子Nestler和Huganir沒有聽取他的意見)。Greengard直到去世前仍活躍在實驗室,包括晚上和週末,通常是和學生一對一改文章。 寫作是科學家的基本技能之一,上文提到的哈佛神經生物學創系主任Kuffler在學術領域涉獵很廣,在各方面都有很高成就,只是他的文章筆者讀起來感覺有點難,也可能是他的研究本身比較複雜或要傳達的資訊較多(當然筆者的寫作也很糟糕,沒有資格去評價像Kuffler這樣的大師)。 但他的學生Hubel和Wiesel的文章則簡潔、清晰、優美,絕對可以作為學術寫作範文來反覆閱讀(Hubel和Wiesel的文章還有個特點,就是參考文獻大部分都是他們自己的文章,這就是耕耘20多年開創一個領域的典型)。不過即便優秀如Hubel和Wiesel,他們最初的寫作也曾遭到他們的導師Kuffler的無情摧殘60。所以寫作是個需要導師指導並勤加練習的技能。 Greengard改文章的風格和他的師爺Brodie頗相似。Brodie通常是晚上八九點約學生來家裡改文章,Brodie愛人提供食物,逐字逐句改,查字典,大聲朗讀,直到每個字都準確,每一句聽過去都優美。一對一改文章也是Greengard和學生互相深入瞭解彼此的最佳時候,基本上是一半工作一半聊天。 Greengard是幽默、笑話、八卦大師,他有時候會和學生挖苦一下競爭對手、為他們的文章被自己超越而感到幸災樂禍、並自信自己的文章將是篇傑作。他也曾為自己沒能共享1994年G蛋白訊號通路的諾貝爾獎而悲傷,通常同一類研究不會再給一個獎,不過好在Greengard 的悲傷並沒有持續太久,6年後他因慢神經傳遞的訊號傳導而獲諾獎。 Greengard一直工作到生命的最後一秒,週六早上,在家讀文獻時突發心臟病去世。這天他原本準備和實驗室博後程嘉討論她的文章。程嘉現為Cell雜誌編輯,她的博士導師顏震曾經也是Greengard的博後,參與DARPP-32的研究,現為紐約州立大學布法羅分校(SUNY Buffalo)教授。下期會介紹顏震讀博期間做的一個結合多巴胺受體和紋狀體通路的研究,補齊多巴胺功能的最後一塊缺口。
未完待續
現在我們知道多巴胺受體是G蛋白偶聯的受體GPCR,一類結合多巴胺後啟用神經細胞(一型受體),另一類結合多巴胺後抑制神經細胞(二型受體)。我們也知道紋狀體SPN細胞有兩條投射通路,一條直接通路促進運動(Go),另一條間接通路抑制運動(NoGo)。那麼多巴胺一型/二型受體和直接/間接通路又有什麼關係呢,多巴胺如何透過影響直接/間接通路來調控運動?顏震做的研究是什麼呢?我們下回分解。
參考文獻:
1. Waldeyer W. Ueber einige neuere Forschungen im Gebiete der Anatomie des Zentralnervensystems. Dtsch Med Wochenschr (1891) 17:1213. doi:10.1055/s-0029-1206893
2. Foster M, Sherrington CS: A Textbook of Physiology. 3. The Central Nervous System, ed 7. London, MacMillan, 1897.
3. Bennett MR: The early history of the synapse: from Plato to Sherrington. Brain Res Bull 1999; 50: 95–118.
4. HODGKIN AL, HUXLEY AF, KATZ B. Measurement of current-voltage relations in the membrane of the giant axon of Loligo. J Physiol. 1952 Apr;116(4):424-48. doi: 10.1113/jphysiol.1952.sp004716. PMID: 14946712; PMCID: PMC1392219.
5. HODGKIN AL, HUXLEY AF. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J Physiol. 1952 Apr;116(4):449-72. doi: 10.1113/jphysiol.1952.sp004717. PMID: 14946713; PMCID: PMC1392213.
6. HODGKIN AL, HUXLEY AF. The components of membrane conductance in the giant axon of Loligo. J Physiol. 1952 Apr;116(4):473-96. doi: 10.1113/jphysiol.1952.sp004718. PMID: 14946714; PMCID: PMC1392209.
7. HODGKIN AL, HUXLEY AF. The dual effect of membrane potential on sodium conductance in the giant axon of Loligo. J Physiol. 1952 Apr;116(4):497-506. doi: 10.1113/jphysiol.1952.sp004719. PMID: 14946715; PMCID: PMC1392212.
8. HODGKIN AL, HUXLEY AF. A quantitative description of membrane current and its application to conduction and excitation in nerve. J Physiol. 1952 Aug;117(4):500-44. doi: 10.1113/jphysiol.1952.sp004764. PMID: 12991237; PMCID: PMC1392413.
9. Dale H.H. and Ewins AJ. (1914) Choline esters and muscarine. Proc. Physiol. Soc. 48,24-25.
10. Dale, H.H. The action of certain esters and ethers of choline, and their relation to muscarine. J. Pharmacol. Enp. Ther., 1914, 6: 147-190.
11. Loewi O: Über humorale Übertragbarkeit der Herznervenwirkung. I. Mittei‐lung. Pflügers Arch Ges Physiol 1921; 189: 239–242
12. Loewi O: Über humorale Übertragbarkeit der Herznervenwirkung. I. Mittei‐lung. Pflügers Arch Ges Physiol 1922; 193:201-213.
13. Dale HH. Otto Loewi, 1873-1961. Biogr. Mems Fell. R. Soc. 8: 67–89
14. Karczmar AG. The Otto Loewi Lecture. Loewi's discovery and the XXI century. Prog Brain Res. 1996;109:1-27, xvii. doi: 10.1016/S0079-6123(08)62084-1. PMID: 9009689.
15. Loewi O. "An Autobiographic Sketch." Perspectives in Biology and Medicine, vol. 4 no. 1, 1960, p. 3-25. Project MUSE, doi:10.1353/pbm.1960.0006.
16. American Chemical Society National Historic Chemical Landmarks. Carl and Gerty Cori and Carbohydrate Metabolism. http://www.acs.org/content/acs/en/education/whatischemistry/landmarks/carbohydratemetabolism.html
17. von Euler U. (1992) Discoveries of Neurotransmitter Agents and Modulators of Neuronal Functions. In: Worden F.G., Swazey J.P., Adelman G. (eds) The Neurosciences: Paths of Discovery, I. Birkhäuser Boston. https://doi.org/10.1007/978-1-4684-6817-5_10
18. Cannon WB. THE ARGUMENT FOR CHEMICAL MEDIATION OF NERVE IMPULSES. Science. 1939 Dec 8;90(2345):521-7. doi: 10.1126/science.90.2345.521. PMID: 17819668.
19. Brooks CM, Eccles JC. An electrical model of central inhibition. Nature, 159, 760-764, 1947.
20. Eccles JC. The synapse: from electrical to chemical transmission. Annu Rev Neurosci. 1982;5:325-39. doi: 10.1146/annurev.ne.05.030182.001545. PMID: 6122420.
21. Carlsson A. Treatment of Parkinson's with L-DOPA. The early discovery phase, and a comment on current problems. J Neural Transm (Vienna). 2002 May;109(5-6):777-87. doi: 10.1007/s007020200064. PMID: 12111467.
22. Barger G, Dale HH. Chemical structure and sympathomimetic action of amines. J Physiol. 1910 Oct 11;41(1-2):19-59. doi: 10.1113/jphysiol.1910.sp001392. PMID: 16993040; PMCID: PMC1513032.
23. BARGER, G. & EWINS, A.J. Some phenolic derivatives of β-phenylethylamine. J. chem. Soc., 1910; 97, 2253–2261.
24. Mannich, C. and Jacobsohn, W. Über Oxyphenyl-alkylamine und Dioxyphenylalkylamine. Ber.Deut.Chem.Ges., 1910; 43, 189-197
25. Blaschko, H. K. F. (1985). Ulf Svante von Euler. 7 February 1905-10 March 1983. Biographical Memoirs of Fellows of the Royal Society, 31, 145–170.
26. Sir Bernard Katz. The History of Neuroscience in Autobiography. SfN.
27. BROCK LG, COOMBS JS, ECCLES JC. The recording of potentials from motoneurones with an intracellular electrode. J Physiol. 1952 Aug;117(4):431-60. doi: 10.1113/jphysiol.1952.sp004759. PMID: 12991232; PMCID: PMC1392415.
28. Langer SZ, Pinto JE. Possible involvement of a transmitter different from norepinephrine in the residual responses to nerve stimulation of the cat nictitating membrane after pretreatment with reserpine. J Pharmacol Exp Ther. 1976 Mar;196(3):697-713. PMID: 4607.
29. Sulzer D, Joyce MP, Lin L, Geldwert D, Haber SN, Hattori T, Rayport S. Dopamine neurons make glutamatergic synapses in vitro. J Neurosci. 1998 Jun 15;18(12):4588-602. doi: 10.1523/JNEUROSCI.18-12-04588.1998. PMID: 9614234; PMCID: PMC6792695.
30. Tritsch NX, Ding JB, Sabatini BL. Dopaminergic neurons inhibit striatal output through non-canonical release of GABA. Nature. 2012 Oct 11;490(7419):262-6. doi: 10.1038/nature11466. Epub 2012 Oct 3. PMID: 23034651; PMCID: PMC3944587.
31. Kim JI, Ganesan S, Luo SX, Wu YW, Park E, Huang EJ, Chen L, Ding JB. Aldehyde dehydrogenase 1a1 mediates a GABA synthesis pathway in midbrain dopaminergic neurons. Science. 2015 Oct 2;350(6256):102-6. doi: 10.1126/science.aac4690. PMID: 26430123; PMCID: PMC4725325.
32. Ren J, Qin C, Hu F, Tan J, Qiu L, Zhao S, Feng G, Luo M. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 2011 Feb 10;69(3):445-52. doi: 10.1016/j.neuron.2010.12.038. PMID: 21315256.
33. Liu Z, Zhou J, Li Y, Hu F, Lu Y, Ma M, Feng Q, Zhang JE, Wang D, Zeng J, Bao J, Kim JY, Chen ZF, El Mestikawy S, Luo M. Dorsal raphe neurons signal reward through 5-HT and glutamate. Neuron. 2014 Mar 19;81(6):1360-1374. doi: 10.1016/j.neuron.2014.02.010. PMID: 24656254; PMCID: PMC4411946.
34. Johnson MD. Synaptic glutamate release by postnatal rat serotonergic neurons in microculture. Neuron. 1994 Feb;12(2):433-42. doi: 10.1016/0896-6273(94)90283-6. PMID: 7906530.
35. Yang B, Sanches-Padilla J, Kondapalli J, Morison SL, Delpire E, Awatramani R, Surmeier DJ. Locus coeruleus anchors a trisynaptic circuit controlling fear-induced suppression of feeding. Neuron. 2021 Mar 3;109(5):823-838.e6. doi: 10.1016/j.neuron.2020.12.023. Epub 2021 Jan 20. PMID: 33476548.
36. Kaneko T, Akiyama H, Nagatsu I, Mizuno N. Immunohistochemical demonstration of glutaminase in catecholaminergic and serotoninergic neurons of rat brain. Brain Res. 1990 Jan 15;507(1):151-4. doi: 10.1016/0006-8993(90)90535-j. PMID: 1967973.
37. Bean BP. The action potential in mammalian central neurons. Nat Rev Neurosci. 2007 Jun;8(6):451-65. doi: 10.1038/nrn2148. PMID: 17514198.
38. Tsiang-Tung Chang. The History of Neuroscience in Autobiography. SfN.
39. Feng TP. Looking back, looking forward. Annu Rev Neurosci. 1988;11:1-12. doi: 10.1146/annurev.ne.11.030188.000245. PMID: 3284437.
40. Snyder, S. Dr Julius Axelrod, 1912–2004. Neuropsychopharmacol 30, 1764–1766 (2005). https://doi.org/10.1038/sj.npp.1300799
41. Pert CB, Snyder SH. Opiate receptor: demonstration in nervous tissue. Science. 1973 Mar 9;179(4077):1011-4. doi: 10.1126/science.179.4077.1011. PMID: 4687585.
42. Sabatini DM, Erdjument-Bromage H, Lui M, Tempst P, Snyder SH. RAFT1: a mammalian protein that binds to FKBP12 in a rapamycin-dependent fashion and is homologous to yeast TORs. Cell. 1994 Jul 15;78(1):35-43. doi: 10.1016/0092-8674(94)90570-3. PMID: 7518356.
43. SUTHERLAND EW, RALL TW, MENON T. Adenyl cylase. I. Distribution, preparation, and properties. J Biol Chem. 1962 Apr;237:1220-7. PMID: 13918525.
44. Miyamoto E, Kuo JF, Greengard P. Adenosine 3',5'-monophosphate-dependent protein kinase from brain. Science. 1969 Jul 4;165(3888):63-5. doi: 10.1126/science.165.3888.63. PMID: 17840687.
45. Sanes J. Paul Greengard (1925-2019). Neuron. 2019 May 22; 102(4): 718-720
46. Livet J, Weissman TA, Kang H, Draft RW, Lu J, Bennis RA, Sanes JR, Lichtman JW. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 2007 Nov 1;450(7166):56-62. doi: 10.1038/nature06293. PMID: 17972876.
47. Kuo JF, Greengard P. Cyclic nucleotide-dependent protein kinases. IV. Widespread occurrence of adenosine 3',5'-monophosphate-dependent protein kinase in various tissues and phyla of the animal kingdom. Proc Natl Acad Sci U S A. 1969 Dec;64(4):1349-55. doi: 10.1073/pnas.64.4.1349. PMID: 4393915; PMCID: PMC223291.
48. Kuo JF, Greengard P. Cyclic nucleotide-dependent protein kinases. VI. Isolation and partial purification of a protein kinase activated by guanosine 3',5'-monophosphate. J Biol Chem. 1970 May 25;245(10):2493-8. PMID: 5445796.
49. Schulman H, Greengard P. Stimulation of brain membrane protein phosphorylation by calcium and an endogenous heat-stable protein. Nature. 1978 Feb 2;271(5644):478-9. doi: 10.1038/271478a0. PMID: 628428.
50. Nestler EJ, Greengard P. Protein phosphorylation in the brain. Nature. 1983 Oct 13-19;305(5935):583-8. doi: 10.1038/305583a0. PMID: 6312325.
51. McAfee DA, Schorderet M, Greengard P. Adenosine 3',5'-monophosphate in nervous tissue: increase associated with synaptic transmission. Science. 1971 Mar 19;171(3976):1156-8. doi: 10.1126/science.171.3976.1156. PMID: 4322706.
52. Kebabian JW, Greengard P. Dopamine-sensitive adenyl cyclase: possible role in synaptic transmission. Science. 1971 Dec 24;174(4016):1346-9. doi: 10.1126/science.174.4016.1346. PMID: 4332627.
53. Kebabian JW, Petzold GL, Greengard P. Dopamine-sensitive adenylate cyclase in caudate nucleus of rat brain, and its similarity to the "dopamine receptor". Proc Natl Acad Sci U S A. 1972 Aug;69(8):2145-9. doi: 10.1073/pnas.69.8.2145. PMID: 4403305; PMCID: PMC426888.
54. Kebabian JW, Calne DB. Multiple receptors for dopamine. Nature. 1979 Jan 11;277(5692):93-6. doi: 10.1038/277093a0. PMID: 215920.
55. McAfee DA, Greengard P. Adenosine 3',5'-monophosphate: electrophysiological evidence for a role in synaptic transmission. Science. 1972 Oct;178(58):310-2. doi: 10.1126/science.178.4058.310. PMID: 4346045.
56. Tsien RW, Giles W, Greengard P. Cyclic AMP mediates the effects of adrenaline on cardiac purkinje fibres. Nat New Biol. 1972 Dec 6;240(101):181-3. doi: 10.1038/newbio240181a0. PMID: 4343950.
57. Richard Tsien. The History of Neuroscience in Autobiography. SfN.
58. Greengard P. The neurobiology of slow synaptic transmission. Science. 2001 Nov 2;294(5544):1024-30. doi: 10.1126/science.294.5544.1024. PMID: 11691979.
59. Barbano PE, Spivak M, Flajolet M, Nairn AC, Greengard P, Greengard L. A mathematical tool for exploring the dynamics of biological networks. Proc Natl Acad Sci U S A. 2007 Dec 4;104(49):19169-74. doi: 10.1073/pnas.0709955104. Epub 2007 Nov 21. Erratum in: Proc Natl Acad Sci U S A. 2008 Apr 15;105(15):5945. PMID: 18032599; PMCID: PMC2148263.
60. Hubel DH, Wiesel TN. Early exploration of the visual cortex. Neuron. 1998 Mar;20(3):401-12. doi: 10.1016/s0896-6273(00)80984-8. PMID: 9539118