首個國產新冠特效藥來了!
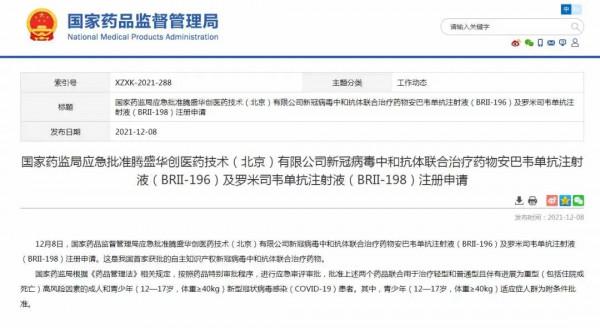
據國家藥監局網站訊息,12月8日,國家藥品監督管理局應急批准騰盛華創醫藥技術(北京)有限公司新冠病毒中和抗體聯合治療藥物安巴韋單抗注射液(BRII-196)及羅米司韋單抗注射液(BRII-198)註冊申請。
這是我國首家獲批的自主智慧財產權新冠病毒中和抗體聯合治療藥物。
國家藥監局根據《藥品管理法》相關規定,按照藥品特別審批程式,進行應急審評審批,批准上述兩個藥品聯合用於治療輕型和普通型且伴有進展為重型(包括住院或死亡)高風險因素的成人和青少年(12—17歲,體重≥40kg)新型冠狀病毒感染(COVID-19)患者。其中,青少年(12—17歲,體重≥40kg)適應症人群為附條件批准。
11月9日至今,騰盛博藥股價累計上漲近137.78%。據中國證券報,券商預計,中和抗體整體市場體量將達到80億-100億美元。
啟信寶資料顯示,騰盛華創醫藥技術(北京)有限公司(簡稱“騰盛華創”)成立於2020年5月份,註冊資本約為5000萬元,法定代表人為羅永慶,經營範圍包括技術開發、技術諮詢、技術轉讓、藥品委託生產、藥品零售等。
從股權結構來看,騰盛華創的控股股東是騰盛博藥醫藥技術(香港)有限公司,系香港上市公司騰盛博藥-B(02137.HK)的全資孫公司。第二大股東是由深圳衛健委、深圳市第三人民醫院舉辦的深圳國家感染性疾病臨床醫學研究中心,持股13.34%。

據悉,此次獲批的新冠抗體藥物由清華大學、深圳市第三人民醫院和騰盛博藥合作研發。
公司近日釋出的III期臨床結果積極。騰盛博藥12月5日晚間公告,公司在研的新型冠狀病毒聯合療法(即安巴韋單抗/羅米司韋單抗聯合療法),在疾病進展高風險的門診患者中,住院及死亡的複合終點降低80%,治療組受試者在28天治療期內無死亡,而安慰劑組有9例死亡。
公告還提及,此次體外嵌合病毒實驗資料,安巴韋單抗/羅米司韋單抗聯合療法對廣受關注的主要SARS-CoV-2變異株{包括以下常見病毒變異株:B.1.1.7(阿爾法)、B.1.351(貝塔)、P.1(伽馬)、B.1.429(伊普西龍)、B.1.617.2(德爾塔)、AY.4.2(德爾塔加)、C.37(拉姆達)及B.1.621(繆)}均保持中和活性。目前正在對近期出現的B.1.1.529(奧密克戎)變異株進行檢測。
今年10月,騰盛博藥向FDA提交了其在研的新型冠狀病毒BRII-196/BRII-198聯合療法緊急使用授權(EUA)申請。
中和抗體療法,簡單地說就是人為地補給抗體來支援免疫系統。據中國證券報,中和抗體整體市場體量將達到80億-100億美元。
目前,全球已有20款中和抗體藥物獲批臨床,國內在研治療新冠中和抗體藥物至少有10款。除了新冠中和抗體藥物之外,四季度以來,國內在研的新冠小分子口服藥在快速推進。
國金證券表示,考慮到口服藥物的便利性、產能優勢及成本優勢,預計2022年小分子口服藥物將強勁增長。
產業鏈相關公司受關注度上升
新冠口服藥CDMO產業鏈相關個股備受關注。CRO公司博騰股份和凱萊英最近公佈了“神秘大單”,儘管兩家公司均因簽訂保密協議,未公佈客戶資訊,但業內普遍認為兩家公司的客戶均是輝瑞。
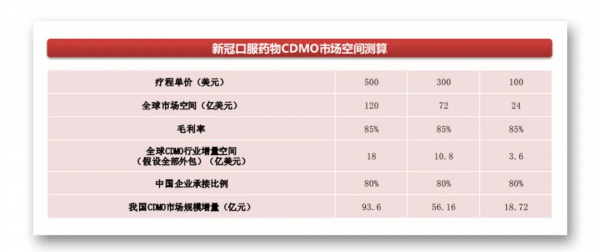
據中國證券報,西南證券預測,假設口服藥物每療程單價分別為500、300、100美元,新冠口服藥物市場空間分別為120億、72億、24億美元,對應我國CDMO市場規模增量分別為94億、56億、19億元人民幣。
中泰證券認為,新冠疫情將在12月持續催化相關板塊。醫藥板塊經過前期的調整,風險得到一定釋放,板塊持續穩定的基本面具備吸引力,疊加疫情催化,建議重點關注。尋找基本面與疫情共振的標的,尤其關注新冠口服藥CDMO、研發進度靠前的國產創新藥企、疫苗及檢測等。
國金證券表示,預計未來會是疫苗+中和抗體+小分子治療藥物三管齊下,共同控制疫情。目前我國已有3個新冠疫苗加強針獲批,新冠疫苗整體銷售額持續增長。總體來看,新冠疫苗產品在2021年的銷售額將達到500億-600億元的體量。從增長趨勢看,今年三季度的銷售額已經超過了一季度加二季度的銷售額總和,預計四季度銷售額將進一步增長,超過三季度銷售額。
(宣告:文章內容和資料僅供參考,不構成投資建議。投資者據此操作,風險自擔。)
編輯|程鵬 杜恆峰 王嘉琦
校對|段煉
封面圖來源:視覺中國
每日經濟新聞綜合自國家藥監局網站、中國證券報、市場資訊