聲動力療法利用超聲波與藥物結合,在腫瘤部位釋放有害的活性氧(ROS)。然而,這種治療方法並不十分有效,因為癌細胞可以啟用抗氧化劑防禦系統來對抗它。根據發表在《ACS Central Science》雜誌上的一項研究,科學家用CRISPR/Cas9基因編輯突破了這些防禦系統,使聲動力療法能夠有效地縮小小鼠肝癌模型中的腫瘤。
肝細胞癌是最常見的肝癌形式,預後很差,透過切除部分肝臟或移植健康肝臟的手術治療不適合於疾病較晚期的患者。由於超聲波可以滲透到組織深處,因此超聲療法可以成為治療肝細胞癌的一種有效、非侵入性的方法。但目前,癌細胞可以透過啟用一種名為核因子紅細胞2相關因子2(NFE2L2)的基因迅速克服治療,該基因部署了細胞的解毒和抗氧化酶防禦功能。CRISPR/Cas9基因編輯技術已被用於在實驗室中敲除基因表達。因此,馮偉、徐輝雄、陳宇(音譯)及其同事想知道他們是否能透過使用這種技術減少NFE2L2的表達來提高超聲療法的有效性。
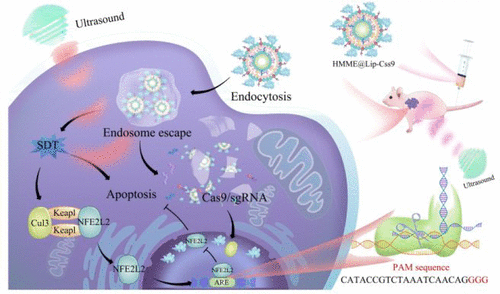
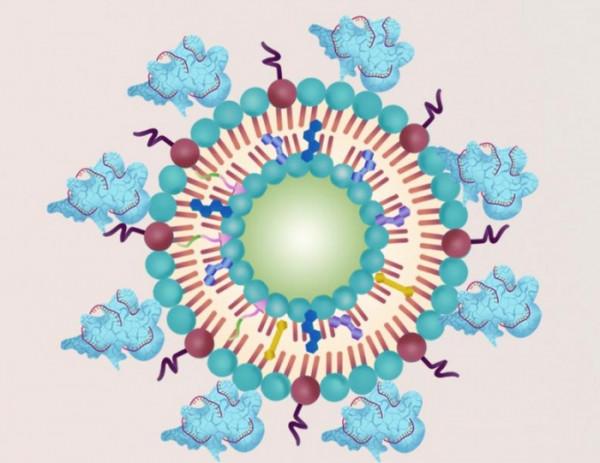
作為第一步,研究人員將CRISPR/Cas9系統和一種ROS前體分子封裝在脂質奈米顆粒中。然後,他們在培養皿中用奈米粒子處理肝癌細胞。脂質奈米顆粒被細胞的溶酶體所吸收。超聲波處理引起了ROS的形成,它使溶酶體破裂,允許CRISPR/Cas9系統進入細胞核並敲除NFE2L2基因表達。ROS還破壞了其他細胞成分。結果,與沒有進行NFE2L2基因編輯的情況相比,有更多的癌細胞在超聲療法中死亡。

接下來,該團隊將奈米粒子療法注入植入人類肝細胞癌腫瘤的小鼠體內。在奈米粒子和超聲聯合治療15天后,小鼠身上的所有腫瘤都消失了,而且沒有再出現。單純用超聲治療的小鼠的腫瘤比未治療的小鼠少,但加入CRISPR/Cas9系統後,治療的效果明顯提高。研究人員表示,由於基因編輯只發生在超聲照射下的腫瘤組織中,它不會導致健康組織的基因突變。