近期,中國研究人員研發出了一種可以三管齊下的肝癌治療新方法,並且這種方法已經在小鼠測試中表現出了不俗的發展前景。據悉,該技術將藥物跟CRISPR-Cas9基因編輯融入脂質奈米顆粒,然後用超聲波啟用它們。

一種新興的抗癌療法被稱為聲動力學療法(SDT),它涉及將藥物輸送到腫瘤中,然後用超聲波脈衝啟用它們。這產生了活性氧(ROS),它可以誘發癌細胞的氧化應激從而殺死它們。然而不幸的是,癌症可以用抗氧化酶來對抗這種攻擊從而降低該方法的效率。
不過在新研究中,研究人員使用了一種可以去除該防禦系統的方法。該團隊懷疑他們可以使用CRISPR來關閉一個名為NFE2L2的基因,而癌細胞會利用該基因來啟動其抗氧化防禦系統。研究團隊將CRISPR機制和產生ROS的藥物都打包到脂質奈米顆粒中,然後用超聲波脈衝啟用。
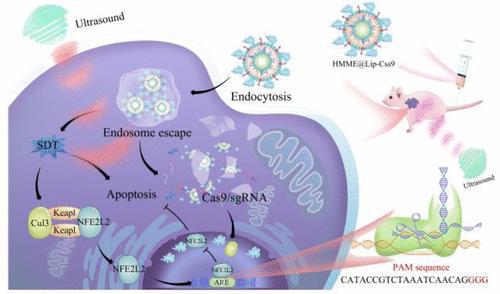
首先,研究團隊在一個培養皿中對一種叫做肝細胞癌(hepatocellular carcinoma)的肝癌細胞測試了該技術。結果顯示,細胞吸收了奈米顆粒,而當應用超聲波時形成了ROS,它能打破細胞的溶酶體。而這反過來讓CRISPR進入細胞核並在那裡它開始工作以此來打破NFE2L2的表達。因此,這帶來了更多的ROS,並跟沒有基因編輯的相同技術相比,損害和殺死的癌細胞明顯增多。
在後續實驗中,該團隊在植入人類肝細胞癌的小鼠身上測試了該技術。雖然跟未經治療的小鼠相比,單獨的SDT確實減少了腫瘤的數量,但同時接受奈米粒子和超聲波的動物在15天后則都有看到它們的所有腫瘤都發生了縮小。
研究團隊表示,該技術的副作用應該會比其他治療方法少,因為ROS和CRISPR只會被釋放到超聲波脈衝所指向的區域的細胞中。跟一種叫做光動力療法的相關技術相比,超聲波還能更深入地滲透到組織中,後者由紅外光引發。
當然,科學家們仍需要跨越動物試驗和人體試驗之間的鴻溝,但不管怎樣,這是一個有趣的新調查工具。