
阿爾茨海默病(AD)是老年期最常見的慢性疾病,以進行性記憶下降和認知功能減退為特徵。AD不但嚴重影響了病人的生活質量,也給患者家庭和社會帶來沉重負擔。
AD的組織病理學變化主要是老年斑(SP)、神經元纖維纏結(NET),基於此,科學家已經提出了β澱粉樣蛋白假說[1]和Tau蛋白異常磷酸化假說[2]來解釋發病機制。儘管在發病機制的研究方面取得了進展,但迄今為止,疾病治療的研究幾乎都沒有取得成功。主要原因之一是缺乏能夠全面模擬疾病的動物模型。
實際上,在過去的20年裡,科學家已經開發了200多種AD動物模型。大多數AD模型是過度表達人類App(澱粉樣前體蛋白)基因的轉基因小鼠。這些模型雖然可以觀察到Aβ蛋白的沉積,卻沒有出現其他AD病理特徵,比如tau病理和神經元死亡。因此,如何開發能夠全面模擬AD發病機制的模型,是研究人員急需解決的問題。
近日,來自清華大學藥學院的魯白和郭煒教授領銜團隊在著名期刊Cell Research發表重要研究結果[3]。
在這項研究中,他們使用CRISPR-Cas9基因編輯技術,用人源化且攜帶三個人類家族突變的App基因成功替換了大鼠同類基因,這就保證了App基因在大鼠體內的正常表達,而避免之前模型的過表達情況。讓人驚喜的是,這個AD大鼠模型表現出類似於AD患者的病理和疾病進展,這在AD模型中尚屬首次。
考慮到與小鼠相比,大鼠的生理行為特徵更接近人類,魯白和郭煒團隊將大鼠作為改造物件。
他們先在NCBI中檢索了大鼠和人類App基因的DNA序列,並分析了由App基因第16、17外顯子編碼的Aβ42肽序列。為了構建App基因敲入大鼠,他們將大鼠App基因的Aβ42的序列及其周圍突變位點序列替換為人類序列。具體來講,就是將Swedish突變(K670N和M671L)引入16號外顯子,將Beyreuther/Iberian(I716F)和Arctic(E693G)突變引入到第17號外顯子。
此外,為了實現Aβ序列的人源化,還引入了G676R、F681Y和R684H三個氨基酸的替換突變。
最後,他們使用CRISPR/Cas9基因敲入技術,獲得純合App敲入大鼠,命名為純合AppNL-G-F。至此,他們成功將三個分佈在App基因的兩個外顯子上的家系突變,同時準確無誤地敲入大鼠基因組,並實現人源化,這是一項非常具有挑戰性的工作[4]。
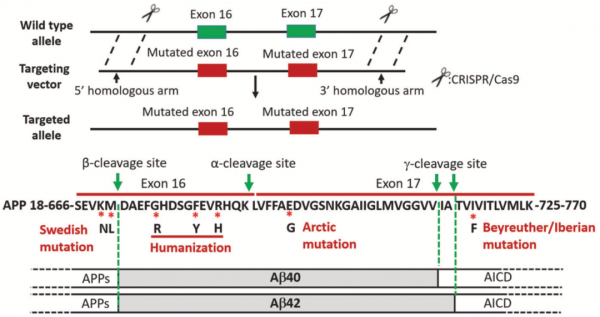
使用CRISPR/Cas9技術產生帶有三個家族突變的App敲入大鼠
為了瞭解這個模型與以往轉基因模型相比的優勢,魯白和郭煒團隊從病理層面和行為層面對該AD模型進行了評估。
首先,AppNL-G-F大鼠確實避免了轉基因技術中App過度表達的問題。App轉基因小鼠最大的缺陷是App蛋白表達水平比正常水平高得多,這會擾亂小鼠的正常生理功能。因此,很難判斷在動物中觀察到的突觸和行為缺陷,是由於Aβ蛋白的沉積,還是由於非生理性表達的App及其代謝物。而嵌合App基因的表達由大鼠內源啟動子驅動,保留了App及其代謝物的內源水平。
其次,模型顯示了全面的Aβ病理學特徵。AppNL-G-F大鼠小腦中存在著豐富的Aβ寡聚體和斑塊,它們在小腦中的空間分佈也與人類AD大腦中的澱粉樣病變相似。
魯白和郭煒團隊還觀察到類似於人類的Tau蛋白異常磷酸化形成神經元纖維纏結(NET)。tau蛋白病理性聚集而形成的神經原纖維纏結是AD的另一個標誌,而迄今為止報告的App突變小鼠模型都沒有表現出tau病理學。這顯示了AppNL-G-F大鼠模型的另一優越性。
此外,這個大鼠模型還表現出由細胞凋亡和壞死性凋亡介導的神經元死亡,以及大腦皮層的嚴重萎縮,從MRI影象上可以觀察到腦室擴大。而無論是轉基因的“一代小鼠模型”[5],還是基因敲入的“二代小鼠模型”[6],都沒有出現神經元的死亡或腦萎縮。

冠狀面上,與 WT 相比,純合AppNL-G-F大鼠的側腦室擴大
在行為層面上,魯白和郭煒團隊測試了AppNL-G-F大鼠的空間學習記憶功能和情景記憶功能。無運動功能障礙的AD大鼠在Morris水迷宮 (MWM) 測試中顯示出空間認知缺陷,無視覺功能障礙的AD大鼠在觸控式螢幕操作測試中顯示情景認知缺陷。這些實驗表明AppNL-G-F大鼠的空間學習記憶以及情景記憶均受損。
除此之外,魯白和郭煒團隊在評估模型的過程中還發現:AppNL-G-F大鼠的病理變化(Aβ沉積、神經膠質增生、tau病理、突觸變性、認知缺陷)發生的時間順序,都與AD患者相似;而且,tau病理總是出現在Aβ沉積之後,這似乎提示著Aβ沉積與tau病理之間存在著因果關係。這些發現為繼續深入研究AD發病機制提供了方向。
更有趣的是,雌性AppNL-G-F大鼠表現出比雄性更具侵襲性的Aβ病理進展,這與在人類中觀察到的非常相似:大約三分之二的AD患者是女性。這提示著AppNL-G-F模型在揭示AD發病性別差異的潛在機制中可能發揮作用。
總之,AppNL-G-F大鼠模型表現出更類似於AD患者的Aβ斑塊沉積、小膠質細胞啟用和神經膠質增生、進行性突觸變性和 AD 相關的認知缺陷,同時研究者還觀察到了 tau 病理學、神經元凋亡和壞死性凋亡以及腦萎縮。
與之前的模型相比之後,不難看出,AppNL-G-F大鼠模型為AD研究、識別新的藥物靶點以及測試治療方法提供了不可或缺的工具。
期待中國科學家的這一重大基礎研究進展,能給AD的治療帶來新的突破。
【1】Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO Mol Med. 2016 Jun 1;8(6):595-608. doi: 10.15252/emmm.201606210. PMID: 27025652; PMCID: PMC4888851.
【2】van der Kant R, Goldstein LSB, Ossenkoppele R. Amyloid-β-independent regulators of tau pathology in Alzheimer disease. Nat Rev Neurosci. 2020 Jan;21(1):21-35. doi: 10.1038/s41583-019-0240-3. Epub 2019 Nov 28. PMID: 31780819.
【3】Pang K, Jiang R, Zhang W, Yang Z, Li LL, Shimozawa M, Tambaro S, Mayer J, Zhang B, Li M, Wang J, Liu H, Yang A, Chen X, Liu J, Winblad B, Han H, Jiang T, Wang W, Nilsson P, Guo W, Lu B. An App knock-in rat model for Alzheimer's disease exhibiting Aβ and tau pathologies, neuronal death and cognitive impairments. Cell Res. 2021 Nov 17. doi: 10.1038/s41422-021-00582-x. Epub ahead of print. PMID: 34789895.
【4】https://www.tsinghua.edu.cn/info/1175/89139.htm
【5】Sasaguri H, Nilsson P, Hashimoto S, Nagata K, Saito T, De Strooper B, Hardy J, Vassar R, Winblad B, Saido TC. APP mouse models for Alzheimer's disease preclinical studies. EMBO J. 2017 Sep 1;36(17):2473-2487. doi: 10.15252/embj.201797397. Epub 2017 Aug 1. PMID: 28768718; PMCID: PMC5579350.
【6】Kawasumi M, Chiba T, Yamada M, Miyamae-Kaneko M, Matsuoka M, Nakahara J, Tomita T, Iwatsubo T, Kato S, Aiso S, Nishimoto I, Kouyama K. Targeted introduction of V642I mutation in amyloid precursor protein gene causes functional abnormality resembling early stage of Alzheimer's disease in aged mice. Eur J Neurosci. 2004 May;19(10):2826-38. doi: 10.1111/j.0953-816X.2004.03397.x. PMID: 15147316.
























