ClinicalTrails.gov 是由美國國立醫學圖書館(NML)與美國食品與藥物管理局(FDA)1997 年開發,2002 年正式執行。
它提供來自 219 個國家超過 38 萬項臨床試驗的註冊資訊,是全球最大的臨床試驗註冊資料庫。
儘管 ClinicalTrails.gov 不提供全面的臨床試驗結果,但可以瞭解正在開展的研究,並按時間順序分析。
日本藤田保健大學醫院花雪秋葵等研究者,使用 ClinicalTrails.gov,針對關節軟骨疾病的細胞療法,透過全面的時間順序分析,來捕捉該領域的全球臨床轉化趨勢,研究發表於 2018 年 10 月。
這項研究的主要結論有:
● 從細胞來源看,有從軟骨、骨髓細胞向脂肪轉變的趨勢
● 骨髓和脂肪來源細胞的臨床研發進展較慢
● I-III期臨床試驗的中位完成時間之和是 8.5 年
主要使用的細胞來源為:骨髓(31%)、軟骨(28%)、脂肪組織(25%)和臍帶/臍血(12%)。
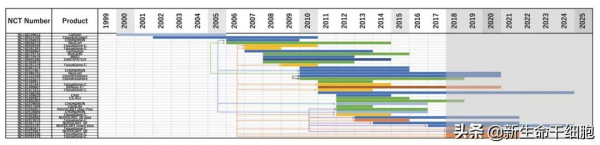
從研究順序上看:
1995 年,軟骨開始被使用併成為主流,但佔比從 45%(2006~2012)逐漸下降到 10-15%(2013~2018)。
2006 年,骨髓第一次被用於軟骨修復,相關研究在 2009 年後更加活躍。
2008 年,脂肪組織開始被使用,並在 2012 年後變得普遍,2014~2015 年以來呈現出替代軟骨、骨髓的趨勢。
2009 年,臍帶/臍血開始被使用。
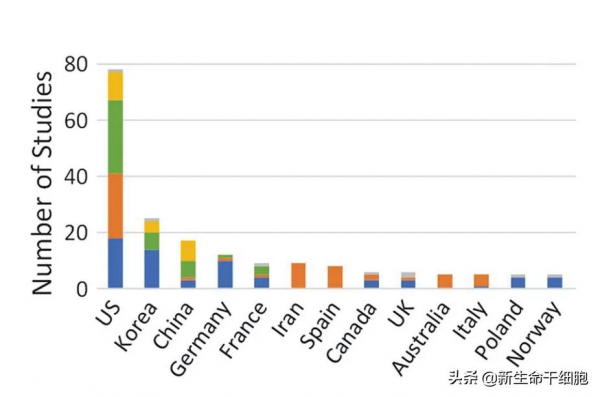
美國、韓國和中國研究數量排在前 3 位。
美國使用軟骨、骨髓和脂肪組織來源的研究,比例大約是 1:1:1;
韓國和德國主要使用軟骨;
中國以臍帶和脂肪組織為主;
伊朗、西班牙和澳大利亞只使用骨髓。
自體細胞的研究約佔 2/3,異體細胞的研究約佔 1/3。
全球市場上可用的軟骨修復細胞治療產品
除了 Cartistem 來源於臍帶血,全球銷售的軟骨修復細胞產品大多數都來源於軟骨。
Carticel 和 ChondroCelect 同屬 第1代 自體軟骨細胞植入(ACI)產品,都在 2016 年退市。
Maci、Chondron和JACC 同屬 第2代 ACI產品,Spherox屬於 第3代 ACI產品,目前臨床趨勢是第 1 代ACI產品被淘汰。
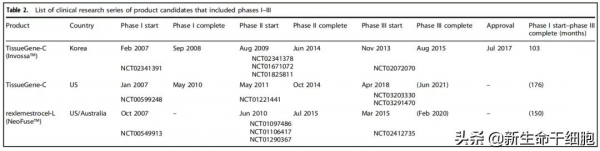
Invossa 是全球首個膝骨關節炎的細胞基因療法,2017 年獲得韓國 MFDS 批准上市,但因虛報細胞來源於 2019 年被禁售。不過,在美國的 III 期臨床試驗被 FDA 恢復。
III 期臨床試驗數量上,自體軟骨細胞有 6 項。
脂肪組織和骨髓(NeoFuse,治療退行性椎間盤疾病)各只有 1 項,反應了這兩種細胞來源的研究進展較慢。
臍帶/臍血有 2 項Cartistem的 III 期臨床試驗。
分析 I - III 期臨床試驗的全部用時:
Invossa(Tissue-Gene-C)在韓國總用時 8.6 年,在美國用時很可能超過 15 年。
NeoFuse 已於 2021 年 4 月完成 III 期臨床試驗,用時 13.7 年。目前 Mesoblast 正計劃與 FDA 會面。
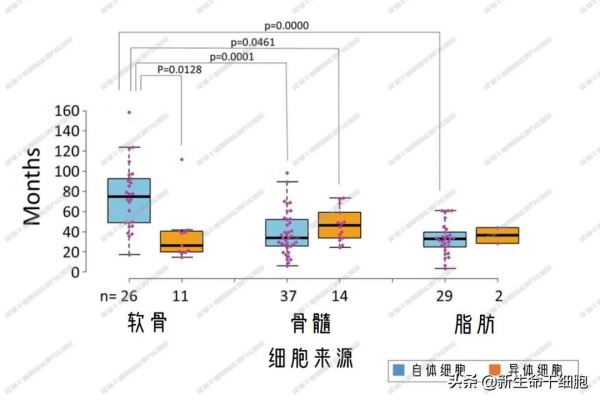
自體軟骨的研究用時,顯著長於異體軟骨和其他來源,主要是因為進入 III 期臨床的比例較高。
分階段用時大致是 III 期 >II 期 >I 期。
將 3 個階段用時的中位時間相加,得到總用時 8.5 年,與 Invossa 在韓國的用時一致。
此外,觀察到一個有利的現象:2015~2017 的總用時比之前減少了 6 個月,但仍需 7.5 年。
另一方面,Carticel 有 20 年的營銷期,但 ChondroCelect 上市 7 年就遭遇退市。
上市時間少於 8.5 年,ChondroCelect 能否收回研發投入,研究者在文中表達了擔憂。
研究者認為,類似日本 PMD 法案的有條件批准,可以縮短產品研發的時間,從而吸引相關投資。
當然,研究者是站在日本監管政策的立場上進行評述,各國監管機構或許有其他的考量。
中外專家發聲臍帶血 臍帶血價值不可否認
小乳牙有大作用,孩子乳牙可千萬別扔
文 | 新生命
圖 | 網路