雷曉光團隊Nat. Catal.:自然界中首例exo選擇性分子間Diels-Alder反應酶
本文來自微信公眾號:X-MOLNews
藥物中間體、農藥、精細化學品在國計民生中佔據重要地位,傳統的化學合成工藝存在效率低和汙染嚴重等瓶頸問題;基於酶催化的生物合成工藝,具有過程綠色、選擇性好等優勢,目前得到了廣泛的應用,特別是在創新藥物的工業化生產中。然而,目前酶催化反應的工具箱還非常有限,能夠催化新穎化學轉化的酶亟待被發現,從而推動酶催化在工業上的更廣泛應用,幫助實現化學品的“碳中和”綠色生物製造。
狄爾斯-阿爾德反應(Diels-Alder reaction,簡稱D-A反應)是共軛雙烯(二烯體)與取代烯烴(親二烯體)之間發生的[4+2]環加成反應,是合成化學中構建C-C鍵最常用的方法之一,已經在天然產物全合成、藥物分子工業化生產以及材料化學等方面得到了廣泛的應用。2021年諾貝爾化學獎授予的有機小分子催化所應用的第一個例項即為不對稱D-A反應。為了實現某一個非對映異構體的高效合成,D-A反應過程中的區域、endo/exo以及對映立體選擇性必須得到精準控制(圖1a)。傳統化學催化的D-A反應存在著立體選擇性差、合成效率低等問題,因此從自然界中挖掘和利用立體專一性的D-A反應酶受到了化學家們的廣泛關注和研究[1]。雖然目前已有一些高立體選擇性D-A反應酶的報道,但它們一般催化的是分子內D-A反應,且往往僅能產生單一的endo構型產物,而合成應用價值更高的exo選擇性的分子間D-A反應酶非常少見,極大限制了D-A反應酶在化學合成中的應用。
近日,北京大學化學與分子工程學院、北大-清華生命科學聯合中心雷曉光實驗室與美國加州大學洛杉磯分校(UCLA)化學系Ken N. Houk實驗室合作,在Nature Catalysis 雜誌線上發表研究論文,報道了自然界中催化不同endo/exo選擇性Diels-Alder反應的酶,利用這兩類酶實現了一系列D-A產物的高效精準合成,並解析了這兩類不同endo/exo選擇性D-A反應酶的催化機制,為後續D-A反應酶的開發和在藥物合成上的工業化應用奠定了基礎。
桑科植物中廣泛存在著結構多樣的D-A型別天然產物,其中一些天然產物具有相同的二烯體和親二烯體結構單元,但其endo/exo構型完全相反,例如chalcomoracin (1) 和mongolicin F (4),如圖1b所示。而在前期的研究中,雷曉光課題組及合作者在白桑愈傷組織中鑑定到首個催化分子間D-A反應的單功能D-A反應酶MaDA,並證明了其催化的分子間D-A反應具有優異的對映立體和endo選擇性,可以用於chalcomoracin (1)、guangsangon E (2) 以及artonin I等endo型別天然產物的高效不對稱合成(Nat. Chem., 2020, 12, 620, 點選閱讀詳細;Biotechnol. J., 2020, 15, 2000119)。然而MaDA並不能催化產生任何exo構型的天然產物(例如mongolicin F(4) 以及guangsangon J (5)),這暗示著桑科植物中還存在著exo選擇性的D-A反應酶,而該酶很有可能就是MaDA的同家族蛋白。
圖1. 桑科植物中D-A反應酶的發現與表徵
透過生物資訊學分析,作者在川桑基因組中共找到41個與MaDA同源的基因,其中有8個基因與MaDA進化關係最近。隨後在白桑基因組中對其中三個基因(MaDA-1、MaDA-2、MaDA-3)進行了擴增,並利用昆蟲表達體系對這三個基因進行外源表達與純化。酶活測試結果顯示MaDA-1也可以催化morachalcone A (7) 與二烯體(8)之間的D-A反應,專一性生成endo構型天然產物chalcomoracin(圖1c);而MaDA-2和MaDA-3主要催化exo選擇性的分子間D-A反應生成mongolicin F,其中MaDA-3(exo/endo = 40:1)比MaDA-2(exo/endo = 13:1)具有更高的exo選擇性(圖1c)。當使用不帶異戊烯基的查爾酮9作為底物時,MaDA和MaDA-3不能檢測到對應D-A產物的生成,而MaDA-1和MaDA-2可以分別催化endo以及exo選擇性D-A反應的發生生成對應的天然產物mulberrofuran C和J(圖1d)。隨後作者也對新發現的endo選擇性D-A反應酶MaDA-1以及exo選擇性D-A反應酶MaDA-3進行了酶學性質表徵。與endo選擇性D-A反應酶MaDA-1(kcat/KM = 1591 ± 251 mM-1•s-1)相比,exo選擇性D-A反應酶MaDA-3反應效率更低(kcat/KM = 13.23 ± 4.12 mM-1•s-1)(圖1e和1f)。
為了進一步證實MaDA-1和MaDA-2/3具有不同的endo/exo選擇性,作者利用MaDA-1和MaDA-2/3作為催化劑實現了一系列D-A型別天然產物的化學酶法合成,透過將酶學產物與天然產物進行比對,證明了MaDA-1的產物均為endo構型的天然產物,而MaDA-2/3的主要產物均為exo構型的天然產物(圖2),隨後透過手性HPLC分析又證實了這些酶學產物均為光學純產物(ee值 > 99%)。這些實驗結果證明了MaDA-1和MaDA-2/3具有一定的底物寬泛性、良好的endo/exo選擇性以及優異的對映立體選擇性,在D-A產物的高效精準合成上具有潛在的應用價值。
圖2. 桑科植物中D-A型別天然產物的化學-酶法合成
為了進一步探究這類D-A反應酶在合成中的應用價值,作者合成並測試了大量非天然的二烯體,發現這類D-A反應酶所能識別的最小二烯體結構單元為二烯體13。在化合物13的烯基鄰位進一步引入羥基後得到化合物14,MaDA-1和MaDA-3對該化合物的轉化率明顯提高,可以以69%和61%的收率得到光學純的D-A產物endo-26和exo-26(圖3a);在化合物13的烯基對位引入一些大體積取代基時(例如苯酚、苯氧基、苯胺基、雜環化合物等),這類二烯體的轉化率也有所提高;然而在化合物13的烯基間位或鄰位引入大取代基時,這類二烯體並不能被MaDA-1和MaDA-3所識別並轉化。
圖3. D-A型別產物的高效酶法合成
有了這些初步構效關係資訊,作者設計和合成了更多在對位有取代基的化合物13的衍生物,並以morachalcone A (7) 作為親二烯體進行了毫克級的酶催化反應。作者發現,除了endo-17以及endo-22外,MaDA-1催化的 endo選擇性D-A反應的收率大部分在中等以上(48-87%);而對於MaDA-3催化的exo選擇性D-A反應,除了exo-16和exo-19的收率相對較低外,其餘產物的收率與MaDA-1催化的endo產物的收率大致相當。隨後,作者測定了酶促D-A產物的ee值,發現MaDA-1和MaDA-3催化的D-A反應均具有優異的對應立體選擇性,除endo-25外(ee 98%),其餘所有產物的ee值均大於99%,這進一步證實了這類D-A反應酶具有良好的立體選擇性(圖3a)。
作者還合成了12個不同的非天然親二烯體,並測定了這些非天然親二烯體與天然二烯體8或10之間的酶促反應轉化率。隨後選取轉化率較高的底物進行了毫克級酶促反應,並對反應產物進行了純化與表徵,如圖3b所示。此外,作者發現這類D-A反應酶還能立體專一性地催化非天然親二烯體與非天然二烯體之間的D-A反應生成D-A產物32和33(圖3c)。這些結果充分證實了MaDA-1和MaDA-3具有很高的底物耐受性以及立體專一性,在D-A產物的精準高效合成上具有一定的應用價值。
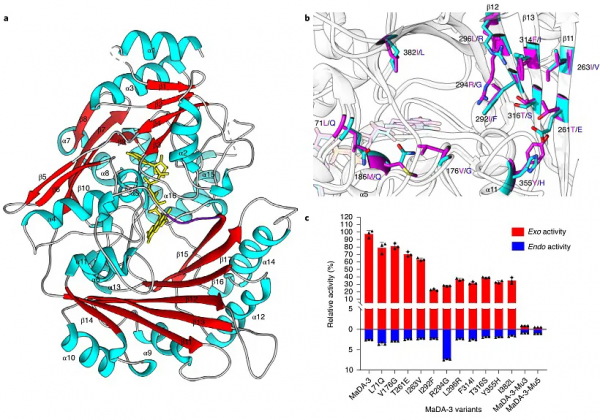
為了探究這類D-A反應酶如何控制反應過程中的endo/exo選擇性,作者首先解析了exo選擇性D-A反應酶MaDA-3的晶體結構(圖4a)。透過仔細比對endo選擇性D-A反應酶MaDA與MaDA-3的晶體結構,在二者的底物結合口袋共發現了12個有差異的氨基酸殘基(圖4b)。作者將MaDA-3中的這12個殘基分別突變成MaDA中對應的殘基,並評估了這些單點突變對於MaDA-3選擇性的影響。結果顯示所有的突變均會降低exo活性從而降低MaDA-3的exo選擇性。有意思的是,R294G的單突變還會顯著增加MaDA-3的 endo活性,使得MaDA-3的exo選擇性從40:1下降到3.8:1,是12個位點中對於exo選擇性影響最大的位點(圖4c)。在R294G突變的基礎上再引入兩個相鄰位點的突變(I292F, L296R)會進一步降低MaDA-3的總催化活性,所得的MaDA-3-Mu3蛋白基本喪失了exo選擇性(exo/endo = 1:1);在MaDA-3-Mu3的基礎上再引入兩個突變(F314I, T316S)後,所得到突變體MaDA-3-Mu5展示出了一定的endo選擇性(exo/endo = 1:2),如圖4c所示。
圖4. MaDA-3的晶體結構以及基於結構的突變實驗
隨後作者還透過計算模擬以及突變實驗進一步探究了endo選擇性D-A反應酶MaDA的催化機制。在MaDA與endo過渡態TS1(endo)的結合模型中,Y412、E414以及R443形成了氫鍵相互作用網路,並透過R443與親二烯體之間形成氫鍵來活化親二烯體。此外,親二烯體還可以與S316和Y194形成氫鍵相互作用,而二烯體可以與F375形成很強的π-π相互作用(圖5a)。對以上位點進行突變後,除Y412F突變體外,其餘突變均會造成MaDA活性的顯著下降(圖5b),這也說明了Y412與E414之間的氫鍵相互作用對於MaDA活性的影響並不大。作者還透過分子動力學模擬對endo過渡態TS1(endo)與MaDA的結合穩定性進行了研究。如圖5c所示,TS1(endo)能夠較穩定的結合在FAD所在的MaDA底物結合空腔內,而exo過渡態TS1(exo)並不能穩定結合在該空腔內。
圖5. 基於計算模擬和突變實驗的D-A反應酶催化機制解析
利用同樣的策略,作者對exo選擇性D-A反應酶MaDA-3也進行了機制解析。exo過渡態TS1(exo)在MaDA-3中結合模式與TS1(endo)在MaDA中的結合模式很相似,但親二烯體整體上更靠近FAD。MaDA中觀察到的Y412/E414/R443氫鍵網路在MaDA-3中被R294/E414/R443所替代。此時MaDA-3中R443不再能與親二烯體形成氫鍵相互作用,而R294可以與親二烯體形成cation-π相互作用從而催化exo選擇性D-A反應的發生(圖5d和5e)。除此之外,MaDA-3中的F375也能二烯體形成較強的π-π相互作用,而T316也可以透過氫鍵相互作用提高MaDA-3的活性(圖5d和5e)。分子動力學模擬計算也進一步證實TS1(exo)可以比較穩定地結合在MaDA-3的催化口袋中,而TS1(endo)則不能穩定結合到MaDA-1中(圖5f)。
最後,作者利用DFT theozyme calculation的方式建立了MaDA以及MaDA-3的theozyme 模型。在MaDA催化的endo選擇性D-A反應中,R443透過與親二烯體形成氫鍵相互作用可以使的該反應的活化能從22.2降低至20.3。而在MaDA-3催化的exo選擇性D-A反應中,R294透過與親二烯體的苯環形成cation-π相互作用,可以將該反應的活化能從23.7降低至20.8。因此也較好的解釋了兩種不同endo/exo選擇性D-A反應酶在催化機制上的差異(圖6)。
圖6. 兩種不同選擇性D-A反應酶的DFT theozyme calculation。
小結
北京大學雷曉光課題組以及UCLA的K. N. Houk課題組合作報道了兩種不同功能的FAD依賴蛋白,它們催化了不同endo/exo選擇性D-A反應的發生,並證實了這類D-A反應酶具有良好的底物適用性以及立體選擇性,在D-A產物的精準高效合成上具有重要的價值。此外,基於結構生物學、計算化學以及突變實驗,雷曉光課題組及Houk課題組還解析了不同選擇性D-A反應酶的催化機制,證明了endo型別D-A反應酶主要是透過R443與親二烯體形成氫鍵來促進D-A反應的發生;而exo型別D-A反應酶主要透過R294與親二烯體形成cation-π相互作用來促進反應的發生(圖7)。
圖7. 全文總結
在該工作中,雷曉光課題組特聘副研究員高磊博士,K. N. Houk課題組博士後鄒一可博士,雷曉光課題組博士後劉小晶博士和博士研究生楊軍為共同第一作者。雷曉光教授以及加州大學洛杉磯分校的K. N. Houk教授為共同通訊作者。雷曉光課題組特聘副研究員範俊萍博士以及博士後杜曉霞博士在晶體結構解析方面做出了重要貢獻。雷曉光課題組的博士研究生王進、於欣水也在底物合成以及基因擴增方面提供了幫助。K. N. Houk課題組的Jiang Mingxuan以及Li Yuli也在DFT calculation上提供了幫助。該工作得到國家自然科學基金,國家科技部重點研究發展計劃,北京市“卓越青年科學家計劃”,北京分子科學國家研究中心,北大-清華生命科學聯合中心等多個國家重大科研專案和研究機構的資助。同時也特別感謝瑞士諾華製藥公司對雷曉光課題組酶催化研究的資助與深入科研合作。
Enzymatic control of endo- and exo-stereoselective Diels–Alder reactions with broad substrate scope
Lei Gao, Yike Zou, Xiaojing Liu, Jun Yang, Xiaoxia Du, Jin Wang, Xinshui Yu, Junping Fan, Mingxuan Jiang, Yuli Li, K. N. Houk & Xiaoguang Lei
Nat. Catal., 2021, DOI: 10.1038/s41929-021-00717-8
參考文獻:
[1] Jeon, B. S., Wang, S.-A., Ruszczycky, M. W., Liu, H. W. Natural [4+2]-cyclases. Chem. Rev., 2017, 117, 5367