非酒精性脂肪肝(NAFLD)包括一系列肝損傷,從單純脂肪變性到非酒精性肝炎(NASH),後者可發展為肝硬化和肝癌(HCC)。目前,NAFLD缺乏有效的治療藥物。除非存在繼發性飲食或化學肝毒性損傷,常用的遺傳小鼠模型不會自發進展到肝纖維化、硬化和肝癌。因此,創造嚴重疾病表型(如纖維化和HCC)快速進展的遺傳模型,對於理解該疾病的發病致病機制以及評估抗NASH和抗纖維化候選藥物的治療潛力巨大。
在磷脂合成途徑中,磷脂酸(PA)可作為甘油三酯和磷脂醯肌醇(PI)的共同前體,其下游的代謝調控決定脂類代謝的流向。中國科學院遺傳與發育生物學研究所黃勳實驗室前期研究表明,胞嘧啶二脂醯甘油合成酶(CDP-DAG synthase,CDS)將磷脂酸(PA)從合成甘油三酯轉到合成磷脂醯肌醇,調控脂類存貯過程向胰島素訊號通路介導的細胞生長過程的轉化(Liu et al, PLoS Genetics, 2014)。黃勳實驗室最新研究發現,小鼠CDS2水平在遺傳或飲食誘導的NAFLD模型中下調。CDS2的肝臟特異性缺失引起NASH快速發生:五週齡小鼠即出現肝臟脂肪變性、炎症和纖維化。機制上,CDS2在介導內質網-線粒體間脂類運輸的線粒體相關膜(MAM)上有定位,且肝臟Cds2缺失會損害線粒體功能並降低線粒體磷脂醯絲氨酸(PS)和磷脂醯乙醇胺(PE)水平。過表達線粒體PE合成酶PISD可減輕肝臟Cds2缺失小鼠的NASH樣表型以及肝細胞中CDS2缺失引起的線粒體形態和功能異常。此外,飲食補充增強線粒體功能的PPARα激動劑也可減輕肝臟Cds2缺失小鼠線粒體缺陷,並改善NASH樣表型。CDS2過表達可以防止高脂飲食引起的肝脂肪變性和肥胖。該研究為Cds2在維持線粒體形態、脂質組成和功能中的作用提供了證據,並提供了一個不需要二次飲食或化學肝毒性損傷的體內模型,為獲得從脂肪變性到NASH和纖維化轉變的機制研究提出了新見解(Xu et al.,Science Bulletin, In press)。研究工作得到科技部、國家自然科學基金的支援。
在CDS2的調控方面,黃勳實驗室參與澳大利亞新南威爾士大學Hongyuan Yang團隊的研究發現,AGPAT2(1-醯基甘油-3-磷酸 O-醯基轉移酶-2)和CDS1/2可直接相互作用並形成功能複合物。AGPAT2缺失降低了CDS蛋白的穩定性,導致細胞系和小鼠肝臟中的CDS活性下降。肝臟AGPAT2缺失也會造成肝臟CDS2缺失類似的脂肪變性的表型。這部分工作為磷脂合成途徑中關鍵分支的代謝通量調節提供了新的分子見解(Mak et al., Nature Communications, 2021)。
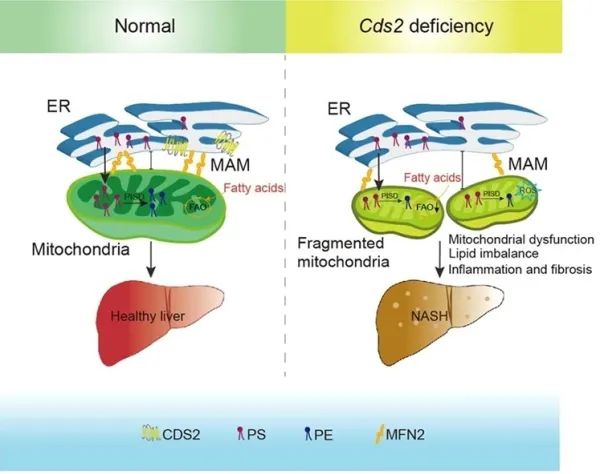
圖1.Cds2缺乏促進NASH發展的可能機制(Xu et al., Science Bulletin, In press)
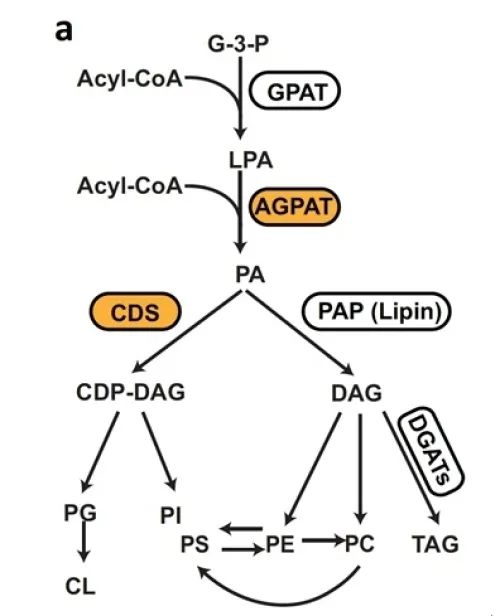
圖2.CDS和AGPAT共同調控磷脂合成途徑中磷脂酸的代謝通量(Mak et al., Nature Communications, 2021)
來源:中國科學院遺傳與發育生物學研究所