通常我們所說的化療,即透過化學藥物消滅癌細胞,是最常用的治療癌症的方法之一。化療的治癌功效雖然明顯,但是也會帶來骨髓抑制、噁心嘔吐、脫髮等非常嚴重的副作用。
這是因為化學藥物常常“敵我不分“,把正常細胞當成癌細胞去攻擊。因此,尋求能夠精準作用於癌細胞的靶向藥物迫在眉睫。
奈米顆粒作為抗腫瘤藥物,有著天生的優越性,主要體現在兩個方面:第一,奈米顆粒具有高滲透長滯留效應(EPR),比起正常組織,更容易滲透進腫瘤組織,並且滯留時間長;第二,奈米顆粒可以靈活變換尺寸和容積,更好地發揮抗腫瘤效果。
儘管已經擁有了相對的優勢,但奈米藥物的研發仍然面臨許多困難。比如,奈米顆粒釋放藥物產生的效應物質容易被降解,同時,藥物還可能被缺氧細胞地P-糖蛋白泵出來,導致藥物的利用率下降。所以,如何加強奈米顆粒釋放藥物的滲透和滯留是急需突破的事情。
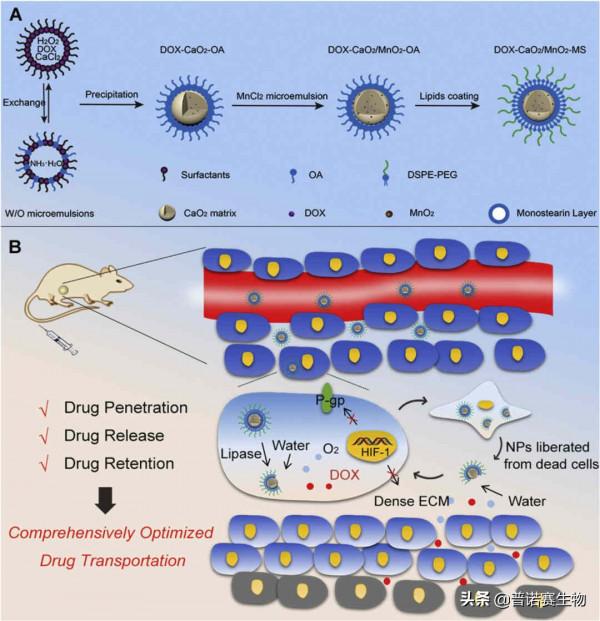
華中科技大學的Jun Luo, Xiang Ma,和Guangya Xiang團隊,合作研發了一種用monostearin(MS)包被CaO2/MnO2的新型奈米載體,用它裝載阿黴素(DOX)並作用於腫瘤時,MS外殼被腫瘤細胞中的脂肪酶水解,經過一系列化學反應,DOX和氧氣從載體中釋放,成功消滅腫瘤細胞。
死亡的腫瘤細胞繼續釋放已經暴露核心的載體,DOX在腫瘤細胞外基質中釋放和擴散,進入腫瘤組織深處。同時,氧氣減少了胞外基質中的膠原沉積,並抑制P-糖蛋白,有效增加藥物在腫瘤組織中的滯留時間。
這項研究於2021年1月19日發表在國際期刊Acta Pharmaceutica Sinica B(IF=11.413(2021)),題為《A smart O2-generating nanocarrier optimizes drug transportation comprehensively for chemotherapy improving》。Xiaojuan Zhang、Chuanchuan He、Guangya Xiang為該研究的設計者。

▲ 該研究發表於國際期刊Acta Pharmaceutica Sinica B
那麼,這種新型奈米藥物抗腫瘤效果究竟如何呢?
首先,研究團隊透過在人卵巢癌細胞系SKOV3上做體外測試,發現藥物很快被細胞吸收。他們在培養基裡新增DOX- CaO2/MnO2 -MS奈米藥物,0.5小時後在細胞質中檢測到DOX,4小時後DOX進入細胞核。
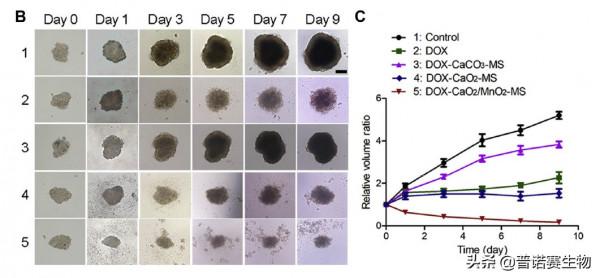
對SKOV3進行缺氧培養,發現缺氧條件下藥物對細胞的毒性增強。用該奈米藥物處理SKOV3的MCTS(multicellular tumor spheroids)模型,24小時後即可到達組織深處,繼續觀察後,發現它能夠很好地抑制MCTS模型的生長。
SKOV3細胞MCTS模型的生長抑制作用
其次,向SKOV3細胞異種移植的裸鼠注射DOX- CaO2/MnO2 -MS奈米藥物(DiR標記),而注射後僅僅4小時,就在腫瘤組織中觀察到熒光,說明該藥物非常迅速且精準地靶標到腫瘤。相比於遊離DOX,DOX- CaO2/MnO2 -MS,它對腫瘤的抑制效果更加明顯。更令人欣喜的是,被注射新藥的小鼠,其體重沒有明顯下降,這證明了藥物具有安全性。
藥物的定位及腫瘤的大小對比
DOX- CaO2/MnO2 -MS奈米藥物,因其巧妙地設計,不僅能夠將核心藥物準確地遞送到腫瘤組織,還能透過氧氣抑制藥物洩露,增加藥物在腫瘤中滯留的時間,協同加強抗腫瘤療效。該研究成果,在其他依賴於氧氣的癌症治療方法中,如光動力治療,放射治療和免疫治療,將有望發揮巨大的應用潛力。