近日,北京理工大學生命學院霍毅欣教授團隊在生物技術領域一區頂級期刊《Trends in Biotechnology》(IF="19.536)發表題為“Constructing" the transcription regulatory network to optimize resource allocation for robustness synthesis”的前瞻性綜述論文,從資源分配這一全新角度審視了微生物細胞工廠魯棒性最佳化的前沿進展,提出了構建“生產導向型”細胞工廠的概念。該論文通訊作者是生命學院霍毅欣教授,第一作者為馬曉焉副研究員,共同第一作者為博士研究生馬煉傑,生命學院分子醫學與生物診療工信部重點實驗室為第一單位。
將微生物改造為細胞工廠進行化學品的發酵生產是實現綠色製造,助力“碳中和”的有效手段。然而,微生物最大化生長的天然使命與高效生產的人工賦能存在根本矛盾,極大阻礙了產量與產率的最大化。論文提出菌株分配資源的“閥門”概念,從轉錄調控網路的全域性水平(Global)、區域性水平(Local)、網路邊緣(Edge)和底層節點(Bottom nodes)四個層級分別探討了改造菌株的中心轉錄調控機器(RNA聚合酶)及其下屬模組的工程策略,論述了“改造轉錄調控網路以重構資源分配模式從而構建生產導向型細胞工廠並全面釋放其生產潛能”這一前瞻性策略。
RNAP核心酶類似於一個多通閥,負責控制資源向增長、維護和生產三個模組的分配。為了構建具有魯棒性的微生物細胞工廠,可以自上而下地對基因調控網路進行改造,從最上層的RNAP核心酶到σ因子和全域性轉錄因子,再到更下層的功能基因,以實現細胞資源的整體重分配和區域性精準引導(圖1B)。綜述透過分析RNAP核心酶結構的最新研究進展(圖1C),針對核心酶與σ因子結合的兩個主要區域(β'亞基的coiled-coil結構域和β亞基的flap結構域)(圖1D),論述了三種調節全酶中的σ因子分佈的不同策略,包括改變RNAP核心酶上與σ因子的相互作用的關鍵區域(圖1E)、改變RNAP核心酶與效應因子之間的相互作用(圖1F)、控制RNAP 核心酶的合成以實現資源分配在生長(A通路)和生產(B通路)之間的切換(圖1G),從而最終可以透過工程式改造RNAP核心酶(斜線填充)實現全域性轉錄調控網路的重程式設計,加強與生產相關模組(深橙色)的表達(圖1A)。
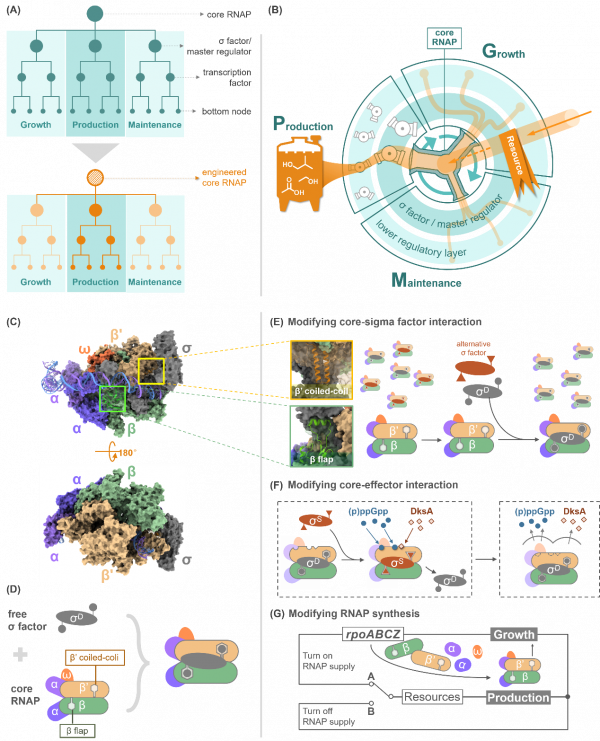
圖1 透過工程式改造RNAP核心酶實現全域性轉錄調控網路的重程式設計
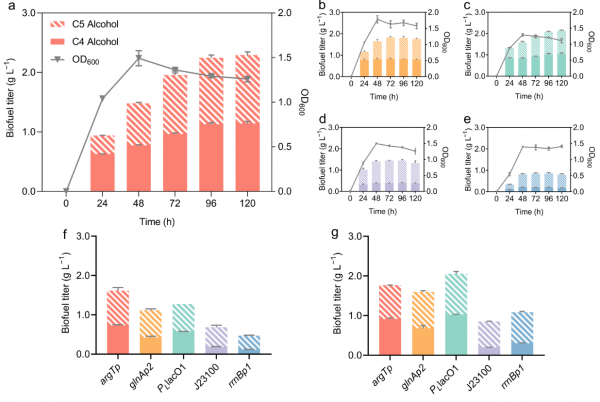
該研究團隊聚焦利用轉錄調控手段提升細胞工廠魯棒性的研究,取得了一系列的研究進展。在全域性調控層面,建立了σ54型RNA聚合酶驅動的合成途徑持續表達系統,解決了σ70型全酶在生長穩定期和脅迫條件下的供應不足問題,實現了合成途徑的自響應、自啟用和自強化,對低pH、高滲透壓等脅迫條件表現出較好的抵禦能力,成功實現了跨越整個生長期和脅迫條件下的高效生物合成。以σ54依賴型啟動子驅動高階醇的生物合成,高階醇產能在進入菌體生長穩定期後持續加強,產量達到常用σ70依賴型啟動子的3倍( Biotechnol Biofuels . 2020, 13:29)。
在網路邊緣層面,開發了抗脅迫模組與生產模組的“偶聯”策略。該研究發現大腸桿菌的穀氨酸依賴型抗酸系統即可被σ70型RNA聚合酶轉錄,又可被穩定期和脅迫條件下大量出現的σ38型RNA聚合酶轉錄,具有全生長期穩定表達的特點。將該系統的轉錄調控機制偶聯高階醇生產途徑,菌株在穩定期的產量提升了25%,酸脅迫下的產量達到現有工程菌株的1.8倍。這一轉錄偶聯策略可有效抵禦脅迫條件下細胞內s因子的更替,驅動細胞工廠在全生長期的持續合成( Appl Microbiol Biot. 2018, 102:6)。
該研究創制了生長期獨立型驅動元件、資源導流元件、表達強度調控元件、代謝資源閥門等在內的多種代謝流調配元件,將代謝流由生長繁殖重定向至產物合成,為當前工業菌株的魯棒性改良提供了新工具。
原文連結:https://www.cell.com/trends/biotechnology/fulltext/S0167-7799(21)00263-8#%20