二氧化碳的性質
一、物理性質
1.無色無味的氣體
2.密度比空氣密度大
二、化學性質
1.不能燃燒,也不支援燃燒
將二氧化碳沿燒杯壁緩慢倒入,燒杯內位置較低的蠟燭先熄滅,說明CO2不能燃燒,也不支援燃燒,以及CO2的密度大於空氣密度。
2.溶於水(CO2 + H2O = H2CO3)
向一個收集滿二氧化碳氣體的質地較軟的塑膠瓶中加入約體積的水,立即旋緊瓶蓋振盪。發現塑膠瓶變扁了,說明瓶內二氧化碳溶於水,瓶內壓強減小,在大氣壓強的作用下,被壓扁。
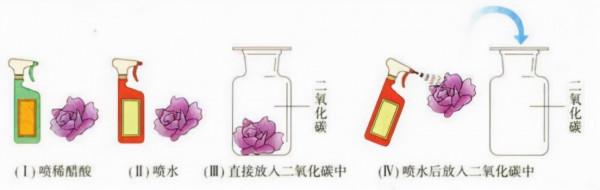
3.屬於酸性氧化物(酸性氧化物是一類能與水作用生成酸或與鹼作用生成鹽和水的氧化物)
取四朵用石蕊溶液染成紫色的乾燥的紫花(石蕊試液遇酸變紅)。
A.第一朵噴上稀醋酸,紫花變紅花。
B.第二朵噴水,一段時間後,紫花變紅花。
C.第三朵直接放入盛滿二氧化碳的集氣瓶中,紫花未變色。
D.第四多噴上水後,再放入盛滿二氧化碳的集氣瓶中,一會兒後,紫花變紅花。
實驗室製取二氧化碳
一、實驗原理
CaCO3+ 2HCl = CaCl2 + H2O + CO2↑
二、藥品:大理石或石灰石(CaCO3)、稀鹽酸
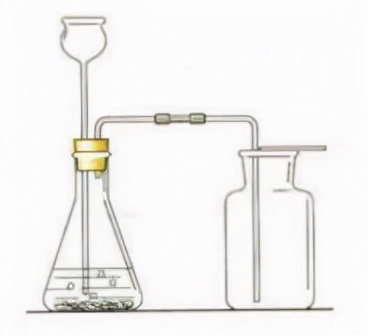
三、器材:錐形瓶、長頸漏斗、雙孔塞、玻璃導管、膠皮管、集氣瓶
四、步驟:
1.連線實驗裝置
2.檢查氣密性
3.在錐形瓶中放入大理石(或石灰石)
4.從長頸漏斗中加入稀鹽酸(不能用濃鹽酸,濃鹽酸具有揮發性,使製得的二氧化碳不純;不能用稀硫酸,碳酸鈣與稀硫酸放於生成的硫酸鈣微溶於水,覆蓋在碳酸鈣表面,阻止反應的發生)、(長頸漏斗下埠應在液麵以下,防止二氧化碳從漏斗口逸出)
5.收集氣體(密度大於空氣密度用向上排空法收集;溶於水,不能用排水法收集)
五、驗滿:將燃燒著的木條靠近集氣瓶口,燃燒著的木條熄滅,則二氧化碳已收集滿。
氣體的檢驗:將氣體通入澄清的石灰水,澄清的石灰水變渾濁,則該氣體為二氧化碳。
(CO2 + Ca(OH)2 = CaCO3↓ + H2O)