Global Blood Therapeutics(GBT)公司近日宣佈,美國食品和藥物管理局(FDA)已加速批准Oxbryta(voxelotor)片劑的補充新藥申請(sNDA),用於治療4歲至12歲以下鐮狀細胞病(SCD)兒童患者。此外,FDA還批准了Oxbryta口服混懸片劑的新藥申請(NDA),這是一種新的、可分散、每日一次的片劑,適用於4歲至12歲以下的兒科患者、以及難以吞嚥整個片劑的年齡較大的患者。此前,Oxbryta片劑劑型已獲美國FDA批准,用於治療年齡在12歲及以上的SCD患者。
鐮狀細胞病(SCD)是一種毀滅性的疾病,可導致器官損傷和預期壽命縮短,而且由於在獲得優質護理方面的巨大差異使情況變得複雜。幸運的是,SCD現在已經進入了治療的新時代。
Oxbryta是一種首創(first-in-class)、每日一次、口服藥物,直接抑制血紅蛋白聚合,這是導致SCD紅細胞鐮狀化和破壞的根本原因。作為首個治療SCD疾病根源的藥物,業界對Oxbryta的商業前景十分看好。此前,醫藥市場調研機構EvaluatePharma釋出報告預測,Oxbryta將成為全球最暢銷的SCD藥物,2024年銷售額預計將達到19.8億美元。
在美國,有10萬多人患有SCD,這是一種遺傳性血液疾病,可導致終身健康問題,其中約有1.6萬是4-11歲的兒童。SCD的併發症始於兒童早期,包括神經認知障礙、急性胸部綜合徵等嚴重問題。此外,SCD限制了兒童的教育程度和社交生活,因為疾病併發症常常導致反覆住院。SCD的早期干預和治療至關重要,並已顯示出改變該疾病病程、減少症狀和事件、預防長期器官損害和延長預期壽命的潛力。
根據患者的年齡、體重和吞嚥片劑的能力,Oxbryta現在將為4歲及以上的患者提供2種劑型:500毫克片劑和300毫克分散片。分散片劑包括葡萄口服,旨在分散在室溫透明飲料中以便於吞嚥(如飲用水或透明蘇打水),使吞嚥整片片劑有困難的患者,尤其是年幼的兒童更容易服用Oxbryta。
Oxbryta兒科sNDA和NDA基於開放標籤2a期HOPE-KIDS 1研究(GBT440-007)的資料。在歐洲血液學協會(EHA)2021年線上會議上,對45名年齡在4至11歲的SCD兒童進行了資料分析,結果表明,使用Oxbryta分散片劑型進行基於體重的治療後,血紅蛋白迅速持續改善,同時也顯示溶血(或紅細胞破壞)減少。
今年4月,GBT公佈了3期HOPE研究的72週數據,結果顯示:接受Oxbryta治療的患者(12歲至65歲),血紅蛋白水平顯著持續改善、溶血減少、整體健康狀況改善。這些結果支援了長期使用Oxbryta來減少SCD患者的溶血性貧血和溶血,從而潛在地減輕危及生命的併發症。HOPE研究是迄今為止時間最長的SCD治療註冊試驗,這些結果進一步證明,透過持續改善SCD的溶血和貧血表現,Oxbryta有潛力成為SCD患者安全有效的疾病修正療法。
GBT總裁兼執行長Ted W. Love表示:“SCD是一種毀滅性的疾病,幾十年來服務嚴重不足,年輕患者的治療選擇有限。SCD的併發症會導致不可逆的器官損害,這就是為什麼早期干預至關重要的原因。今天,FDA批准Oxbryta用於治療4至11歲SCD兒童患者,並批准兒童友好的劑型,這是治療SCD的一個重大進展。GBT非常自豪地引領新藥開發,以解決SCD患者護理不足的問題。”
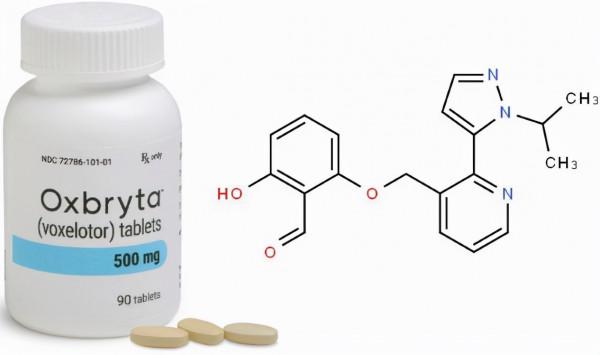
voxelotor分子結構式(圖片來源:drugapprovalsint.com)
鐮狀細胞病(SCD)是一種嚴重的、進行性的、使人衰弱的遺傳性疾病,由β-珠蛋白基因突變導致異常鐮狀血紅蛋白(HbS)的產生。HbS使紅細胞變得病態和脆弱,導致慢性溶血性貧血、血管病變、難以捉摸的和痛苦的血管阻塞危象(VOC)。對於患有SCD的成人和兒童來說,這意味著痛苦的危機和其他改變生命或威脅生命的急性併發症,如急性胸腔綜合徵(ACS)、中風和感染。如果患者在急性併發症、血管病變和終末器官損害中存活,由此產生的併發症可導致肺動脈高壓、腎功能衰竭和早期死亡。
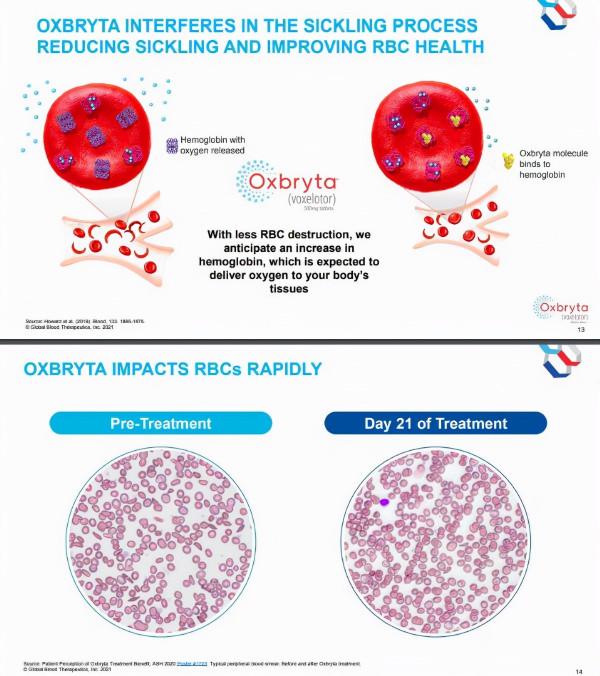
Oxbryta是首個被批准直接抑制鐮狀血紅蛋白聚合治療SCD的藥物。血紅蛋白聚合是導致SCD紅細胞鐮狀化和破壞的根本病因。鐮狀化過程會導致溶血性貧血(紅細胞破壞導致血紅蛋白水平降低),毛細血管和小血管阻塞,阻礙血液和氧氣在全身的流動。組織和器官供氧減少可導致危及生命的併發症,包括中風和不可逆的器官損傷。
Oxbryta的活性藥物成為voxelotor(前稱GBT440),透過增加血紅蛋白對氧的親和力發揮作用。由於氧合的鐮刀血紅蛋白不聚合,voxelotor能阻斷聚合化及由此導致的紅細胞鐮狀化和破壞。voxelotor可改善溶血性貧血和氧運輸,並潛在地改變SCD的程序。
Oxbryta於2019年11月獲得美國FDA加速批准,用於治療年齡≥12歲SCD兒童和成人患者的溶血性貧血。Oxbryta透過FDA的優先審查通道獲得批准,從新藥申請(NDA)被受理到最終批准僅僅用了2個多月時間。此前,FDA已授予voxelotor治療SCD的突破性藥物資格(BTD)、快速通道地位、孤兒藥資格和罕見兒科疾病資格。作為美國FDA加速批准的一個條件,GBT繼續在HOPE-KIDS 2研究中調查Oxbryta,這是一項批准後驗證性研究,使用經顱多普勒(TCD)血流速度來評估Oxbryta降低2-15歲兒童中風風險的能力。
今年1月,歐洲藥品管理局(EMA)受理了Oxbryta的營銷授權申請(MAA),該MAA尋求EMA授予Oxbryta完全批准,用於治療12歲及以上鐮狀細胞病(SCD)患者的溶血性貧血。之前,EMA已授予voxelotor治療SCD的優先藥物資格(PRIME)和孤兒藥資格。GBT還計劃尋求監管部門的批准,以擴大在美國使用Oxbryta治療4歲以下兒童SCD的可能性。
Oxbryta可減少鐮狀化、快速改善紅細胞健康(點選圖片檢視大圖)
HOPE是一項隨機、雙盲、安慰劑對照、國際性、多中心3期研究,對274例年齡在12歲至65歲的SCD患者進行了研究。結果顯示,以美國FDA批准的Oxbryta劑量(1500mg,每日口服一次)進行治療,在72周治療期間,患者血紅蛋白水平得到了迅速而持久的改善。
具體資料為:1500mg劑量Oxbryta治療組有約90%的患者在研究期間的一個或多個時間點血紅蛋白水平較基線檢查改善>1g/dL,而安慰劑組達到這一目標的患者比例僅為25%。此外,1500mg劑量Oxbryta治療組有約59%的患者在一個或多個時間點血紅蛋白水平較基線改善>2g/dL、20%的患者達到改善>3g/dL,而安慰劑組中分別為3%、0%。分析還顯示,接受Oxbryta治療的患者,血管閉塞危象(VOC)數量較少,與24周時的趨勢一致,並且急性貧血發作(血紅蛋白水平較基線水平降低>2g/dL)的可能性減少3倍。
此外,Oxbryta治療組約74%的患者(n=39/53)總體臨床狀況被臨床醫生評定為“中度改善”或“極大改善”,而安慰劑組為47%(n=24/51),這一差異具有統計學意義。Oxbryta治療的總體耐受性良好,72周內治療期間不良事件發生率相似。
最近發表在《美國血液學雜誌》(American Journal of Hematology)上的HOPE研究的事後分析結果評估了SCD患者腿部潰瘍的發生率和預後,資料進一步支援血紅蛋白S聚合抑制在SCD治療中的根本性作用。分析結果顯示,到第72周,接受1500mg劑量Oxbryta治療的全部患者(n=5/5)腿部潰瘍消失,安慰劑組為63%(n=5/8)。腿部潰瘍的消失與血紅蛋白水平的增加和溶血的減少相關。在接受Oxbryta治療期間血紅蛋白增加>1.0g/dL的患者最有可能在24周內經歷腿部潰瘍的消退。這些結果突出了Oxbryta對主要患者結局產生有意義影響的潛力。