越來越多的抗癌新藥和新技術研發上市,讓我們看到人類距離攻克癌症的那天越來越近了。
2021年6月11日,世界上首款治療原發性腦瘤的溶瘤病毒療法在日本獲批的喜訊在癌友圈中刷屏,給病友們帶來了新的生存希望。近期我們再次迎來好訊息,2021年11月1日,溶瘤病毒療法正式在日本獲批用於臨床治療,這意味著,溶瘤病毒正式接收患者了,國內的患者也有機會申請這一全新的前瞻性免疫治療技術。
與傳統的手術,放療,化療不同,溶瘤病毒會精準定向感染癌細胞,保護正常細胞不受損害,因此這款技術自問世就備受國內病友們的關注,上市後全球腫瘤醫生網醫學部接到大量的諮詢電話,為了讓病友們能對這項新技術有全面客觀的認識,全球腫瘤醫生網醫學部針對患者最關心的十個問題進行解答,希望能幫助病友獲取有用的資訊。
一,全球首款治療腦瘤的溶瘤病毒療法正式在日本獲批!
2021年6月11日,日本第一三共(Daiichi Sankyo)公司宣佈,溶瘤病毒療法Delytact(teserpaturev/代號G47∆,下文統稱teserpaturev)已經獲得日本厚生勞動省的批准,正式上市,用於治療惡性膠質瘤!
值得一提的是,這是全球首款獲得批准治療原發性腦瘤的溶瘤病毒療法,是腫瘤治療史上又一值得鐫刻的里程碑!
截至目前,全球共有四款溶瘤病毒療法獲批:
|
溶瘤病毒全球獲批情況概覽 |
|||
|
商品名 |
獲批時間 |
國家 |
適應症 |
|
Rigvir |
2004 |
拉脫維亞 |
黑色素瘤和其他惡性腫瘤 |
|
安柯瑞 |
2006 |
中國 |
鼻咽癌 |
|
Imlygic |
2015 |
美國 |
黑色素瘤 |
|
Delytact |
2021 |
日本 |
腦膠質瘤 |
二,溶瘤病毒療法teserpaturev的前世今生
Teserpaturev是由第一三共和東京大學Tomoki Todo團隊共同開發的第三代溶瘤HSV-1(I 型單純皰疹病毒-HSV-1)。
2016 年 2 月,厚生勞動省授予 teserpaturev突破性療法稱號;
2017 年,teserpaturev獲得了孤兒藥稱號。
2020 年 1 月 5 日 ,正式向日本厚生勞動省提交用於治療惡性膠質瘤患者 的新藥申請。
2021年6月11日正式獲批上市。
2021年11月1日正式批准進入臨床應用。
在此前的2020年AACR大會上,第二代溶瘤病毒G207公佈了研究資料就引起了巨大轟動,在11例患者中觀察到了響應,中位總生存期為12.2個月,比進行性兒童高階神經膠質瘤的典型總生存期增加了120% 。
公佈的案例也非常振奮人心,膠質母細胞瘤接受G207治療前後對比。(A)治療前(B)G207的接種後一個月,表明對G207有明確的反應。
與第二代溶瘤病毒 HSV-1 G207相比,第三代溶瘤病毒Teserpaturev在保持G207基因組原有安全性的同時,引入額外的缺失突變,來增強抗腫瘤效果。新型的溶瘤病毒被證明具有更強的複製能力和更高的抗腫瘤活性,研究發現該療法在神經膠質瘤、乳腺癌、前列腺癌、神經鞘瘤、鼻咽癌、肝細胞癌、結腸直腸癌、惡性周圍神經鞘瘤和甲狀腺癌中均有效。此外,還發現該療法可有效消除人膠質母細胞瘤衍生的癌症幹細胞,具有預防復發的潛力。
三,第三代溶瘤病毒teserpaturev的抗癌原理
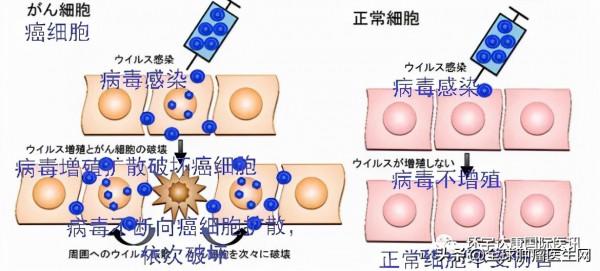
溶瘤病毒,是一種天然或經過基因改造的特殊病毒,能夠選擇性地感染腫瘤細胞,在其內部大量複製並最終裂解腫瘤細胞,達到直接溶瘤的效果。而且溶瘤病毒會大量釋放腫瘤抗原,改善腫瘤微環境,刺激機體產生抗腫瘤免疫反應來持續發揮抗癌功效。
近年來,溶瘤病毒經過不斷的改良,通常採用基因工程,將外源治療性基因插入溶瘤病毒基因組中,使其在腫瘤區域性高表達,可避免病毒引起的全身性免疫應答反應的發生、延長病毒作用的時間、增強病毒殺傷力,目前常用的病毒株包括痘病毒、腺病毒、麻疹病毒和單純皰疹病毒等。
此次獲批的第三代溶瘤病毒採用的就是改良的1型單純皰疹病毒 (HSV-1,一種唇皰疹的常見病因),它可以感染腫瘤細胞,但不能感染正常細胞, 由於HSV-1自然感染周圍和中樞神經系統的細胞,因此對於腦部腫瘤來說可能非常理想。
四,1年生存率92.3%vs15%!teserpaturev臨床資料驚豔
此次,teserpaturev獲批是基於Tomoki Todo博士在東京大學針對複發性膠質母細胞瘤患者進行的單臂2期臨床試驗的卓越資料。
這項研究對比了膠質瘤患者手術後進行放療和化療(替莫唑胺)的標準治療基礎上,追加三次teserpaturev治療。
結果顯示:溶瘤病毒治療組1年的生存率為92.3%(13例中有12例在治療後生存長達1年以上),與標準治療1年生存期15%相比,極大的提高了腦膠質瘤患者的生存率。
五,專家介紹
據報道,這項技術由日本東京大學醫科學研究所附屬醫院腦腫瘤外科教授藤堂具紀教授與日本第一三共株式會社共同研發的,藤堂具紀教授擔任該實驗總負責人。
藤堂具紀
東京大學醫科學研究所附屬病院腦神經外科科長、教授
職務:病院腦神經外科科長
擅長:腦神經外科領域專家,惡性腦腫瘤手術、腦神經腫瘤治療、
病毒療法、遺傳治療專家。日本溶瘤病毒技術研發負責人。
六,teserpaturev的副作用有哪些?
值得一提的是,16名受試者中,發生的主要不良反應為發熱15名(93.8%)、嘔吐及淋巴細胞數減少各8名(50.0%)、噁心7名(43.8%),需要延長住院時間的只有發熱2名(均為輕度)(12.5%)。這表明teserpaturev是一款安全性較高的療法。
七,哪些患者可以接受teserpaturev治療?
teserpaturev理論上可以用於治療惡性膠質瘤或任何型別的原發性腦癌,目前僅獲批用於治療惡性膠質瘤。
膠質瘤起源於腦組織中的神經膠質細胞,佔所有惡性原發性腦腫瘤的近 80%,是最常見的腦瘤之一,也是當之無愧的最致命的癌症之一。平均生存期僅1年,五年生存率不足5%。對於這種腫瘤,目前沒有任何治癒方法,治療很困難。teserpaturev的獲批將給這些患者帶來曙光。
八,teserpaturev的治療價格
teserpaturev目前公佈的價格為143萬日元/ml(針對日本公民),具體治療費用需要日本專家會診後預估。
九,teserpaturev的治療流程
據相關機構介紹,該治療並非一次性的,需要多次給藥:
第1次給藥後隔5-14天進行第二次給藥,第三次之後每4周給藥一次,共需要給藥6次。具體用藥資訊以官方公佈為準。
十,國內的患者如何接受teserpaturev治療?
由於這款療法此次獲得的是“條件性顯示批准”,因此需要在上市後7年再次確認有效性和安全性,需要治療後能在日本定期複查,目前由於全球疫情影響,中國及國際患者需要經過會診後由醫院決定是否可前往接受治療。想申請的患者可致電全球腫瘤醫生網醫學部瞭解詳情。
溶瘤病毒的獲批,開啟了膠質瘤免疫治療的新紀元,給長期沒有有效治療方案的患者帶來了新的曙光,希望這款療法也能儘快來到中國,獲批上市。
未來已來!膠質瘤患者迎來長生存希望!
膠質母細胞瘤雖然是最常見的惡性腫瘤,5年相對存活率僅有6.8%,但相信在不久的將來定會湧現出越來越多的治療新技術和新型藥物針對難治性膠質母細胞瘤,而且本文中提到的各類新的研究也不會止步於此,我們共同期待未來越來越多意想不到的臨床研究成果。