本文來自微信公眾號:X-MOLNews
貽貝,也就是吃貨們熟悉的海虹、淡菜、青口,是一種廣泛分佈於沿海地區的青黑色貝類。為了免受捕食者的困擾,貽貝通常聚集並粘附在海邊滑溜溜的礁石上,任憑風吹雨打海浪拍擊而巋然不動。除了礁石,肆意增殖的貽貝還喜歡附著在船底增加阻力,甚至還能堵塞管道威脅海邊核電站的正常執行。貽貝強大的附著力令幾乎所有人都頭疼不已,除了那些研究高效能水下粘合劑的化學家們。
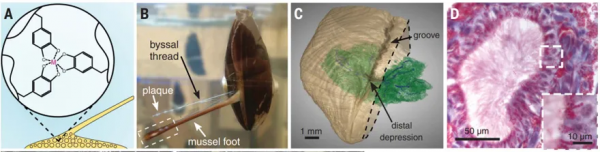
圖1. 附著在礁石、管道里的貽貝及其用於附著的足絲。圖片來源於網路
貽貝超強附著力的秘密武器就是身下的“足絲”。關於足絲的研究可追溯到半個世紀前,研究人員們發現足絲是一種蛋白質-金屬配位複合物,含有高濃度的3,4-二羥基苯丙氨酸(DOPA),其原料——液態原蛋白是由貝足內的可流動的微米級分泌囊泡產生,短短几分鐘即可透過縱向微導管(LDs)內的纖毛運輸分泌出來。
圖2. (A)足絲蛋白,(B)貽貝的貝足,(C)貝足的CT解剖影象可以看到藍色的LD微通道網路與(D)微通道LD的橫切面。圖片來源:Science
足絲蛋白之所以粘附牢固是因為貽貝利用了鐵、釩離子形成具有強大粘合力的DOPA-金屬配位鍵。但由於貽貝堅固的外殼,這種高效粘合劑怎樣在貽貝體內合成,在微導管中運輸時金屬離子怎樣被引入配位……這些問題我們還不得而知。這成為了化學家們研製高效能仿生水下粘合劑路上巨大的絆腳石。
近期Science 的一篇論文,刊登了加拿大麥吉爾大學Matthew J. Harrington等人的研究成果,他們闡述了貽貝足絲蛋白的形成與分泌過程,並發現了金屬離子如何引入併成鍵,揭開了這個多年的秘密。仔細看下來,貽貝堪稱玩轉配位化學與微流控合成的大師。
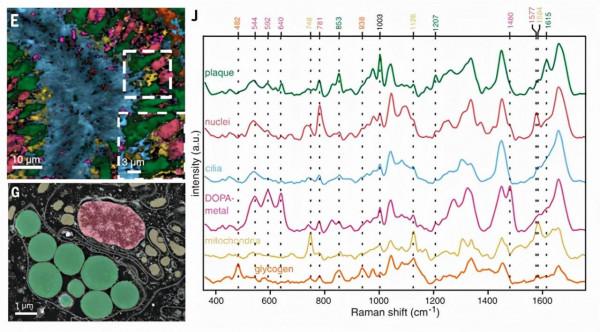
圖3. (E)、(G)分別為微孔道LD縱切面的共焦拉曼(後期上色)和STEM影象(細胞染色),可以看到綠色蛋白囊泡、紅色細胞核、藍色纖毛、粉色金屬儲存囊、黃色線粒體等,顏色分別對應(J)中的拉曼譜線。圖片來源:Science
第一步是研究金屬離子的儲存位置和分泌方式。研究人員首先使用微型X射線熒光(mXRF)檢查了貝足組織切片,可以明確地發現縱向管道LDs周圍分佈著大量的鐵和釩(圖4B)。而透過具有更高空間解析度的STEM-EDS在縱向管道LDs周圍發現了亞微米顆粒,即儲存金屬的微囊(metal storage particle, MSP),圖3中也可觀察到金屬儲存微囊在組織中的分佈。由於用共聚焦拉曼光譜檢測到DOPA-金屬配位所特有的拉曼共振峰(圖4E),表明微囊中的金屬很可能與有機成分有關,以雙齒配位的方式與兒茶酚基配位。
圖4. 金屬微囊泡的形態與內部金屬的分佈及DOPA-金屬配位所特有的拉曼共振峰。圖片來源:Science
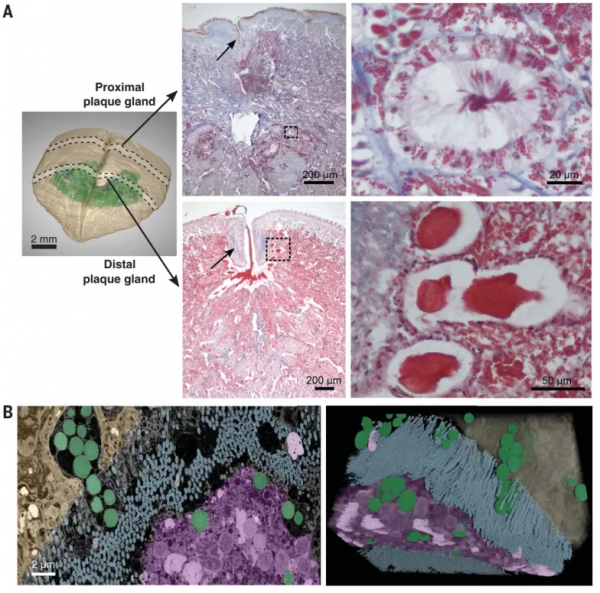
縱向管道LDs組成了一個相互連線的複雜微通道網路,這個大型“加工廠”周圍堆積著生產足絲所需的原材料——原蛋白質和金屬,並配備了將“貨物”運送出去的纖毛。研究人員凍結了縱向管道內足絲蛋白的分泌過程,透過組織成像學觀察到,足絲蛋白囊泡被分泌到微管道中並不斷凝聚(圖5A)。圖5B和下面的動圖則顯示了許多囊泡透過纖毛分泌並在腔內混合在一起的過程。
圖5. 縱向管道中足絲蛋白囊泡分泌過程的組織染色切片與3D重建圖。圖片來源:Science
圖6的拉曼光譜成像顯示,在分泌的早期階段,微通道導管內凝聚的蛋白具有均勻的成分,其光譜與囊泡中觀察到的幾乎相同,而金屬微囊泡則還在周圍組織中(圖6AI);到了分泌後期,在接近分泌出口的位置,金屬微囊泡也被分泌到微導管腔內,並與蛋白質混合(圖6AII),但也僅僅是混合在一起,還未發生配位鍵和;最後,在分泌出口位置,透過拉曼光譜檢測到大量密集的DOPA-金屬配位(圖6AIII),而不均勻的分佈表明金屬離子在金屬微囊泡以及蛋白質中不斷髮生混合和擴散(圖6B)。
圖6. 微導管內金屬微囊泡的分泌過程。圖片來源:Science
金屬離子與蛋白原液的混合過程也是如此的巧妙。金屬微囊泡中的兒茶酚與蛋白-金屬結合強度受到微導管內物理化學條件的影響(如pH值、鹽含量,或者可能是兒茶酚的化學差異)。通常,蛋白原液的儲存和分泌是在pH=2的酸性環境下發生的,此時金屬離子透過兒茶酚的配位親和力是很弱的,從而允許金屬離子在纖毛的作用下在蛋白原液中均勻擴散。而DOPA的雙齒螯合作用通常只在pH值增加時發生。隨著分泌的進行,當pH值增加到海水的微鹼性(pH≈8)時,分散的金屬離子被富含DOPA的足絲蛋白強烈螯合,形成粘性配位鍵,從而機械強化整體足絲結構。
海水中的可溶性鐵和釩的濃度極低,在1-50 nM之間,而貽貝作為一種濾食性動物,其軟組織和其附體中富集了廣泛的水體金屬(包括Ag、Cd、Cr、Cu、Fe、Ni、Pb、Ti、V和Zn等),所以自20世紀70年代以來,貽貝一直被作為重金屬汙染標誌生物。
縱觀整個生物學,生理上有價值的金屬離子(如鐵、鋅、銅)幾乎總是與生物大分子(如鐵蛋白、轉鐵蛋白、金屬硫蛋白等)緊密結合在一起。而金屬釩的發現非常值得注意,因為它很少在生物學中發揮功能作用,特別是作為材料的交聯元素。而最近有研究表明,貽貝可能優先使用DOPA-V交聯機制來機械穩定體外保護層。而且體外奈米力學研究表明,DOPA-V交聯可以提供比DOPA-Fe大兩倍的粘合力。
簡而言之,貝類組織中金屬微囊泡的發現解決了一個長期存在的謎團。首先貝類將海水中吸收的鐵和釩離子富集儲存在細胞內與含兒茶酚分子複合的金屬儲存囊中,在足絲形成過程中,分別儲存有濃縮蛋白原液和金屬離子的兩類分泌囊在微流通道狀的導管網路中混合,並在新生的旁路內形成蛋白質-金屬鍵。金屬配位提供了強大的粘合力,促進流體足絲蛋白在海水條件下固化成固體粘合劑。整個過程堪稱微流控合成的經典案例。
這些發現對開發下一代金屬聚合物粘合劑有著深遠的影響,金屬離子的逐步釋放混合過程與pH值改變引發的液固相變可能會促進新型環境友好3D列印技術的發展,為液體前體自發形成分層多孔固體過程提供了全新的物理化學思路。
PS:除了能發頂刊,筆者覺得在這種課題組是不是可以天天吃海鮮……
Microfluidic-like fabrication of metal ion–cured bioadhesives by mussels
Tobias Priemel, Gurveer Palia, Frank Förste, Franziska Jehle, Sanja Sviben, Ioanna Mantouvalou, Paul Zaslansky, Luca Bertinetti, Matthew J. Harrington
Science, 2021, 374, 206-211, DOI: 10.1126/science.abi9702
(本文由Silas供稿)