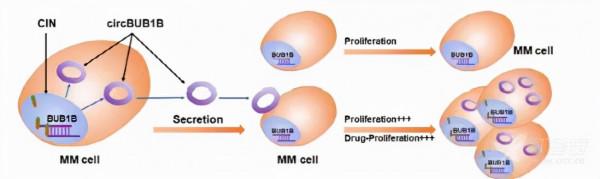
本文熱點有:circRNA;circRNA編碼多肽;染色體穩定性研究
感興趣的小夥伴,關注!點贊!轉發!走起!
在讀本篇文章之前我們要知道的一些背景資訊:
1.【多發性骨髓瘤(MM)】:是起源於骨髓的一種分子遺傳異質性血液系統惡性腫瘤。儘管這些靶向藥物,如免疫調節劑和蛋白酶體抑制劑,幾十年來已經大大改善了MM患者的預後,但是MM仍然威脅著生命,無法治癒。
2.【Bub1有絲分裂檢查點絲氨酸/蘇氨酸激酶B(BUB1B)】:是一種保守的多功能蛋白,對有絲分裂紡錘體檢查點的功能和糾正運動微管附著至關重要。5BUB1B的失活已被證實導致紡錘體檢查點丟失和嚴重的染色體分離缺陷。
3.在作者之前的研究中發現,【染色體不穩定(CIN)加速MM惡性和耐藥的發展】,導致治療失敗和復發,這限制了目前大多數治療方法的有效性。因此,識別與CIN和MM之間關係有關的新分子和訊號通路是至關重要的。
到這裡,晦澀難懂的正文就要開始了。為避免學習過於枯燥,作為新時代的活雷鋒典型代表的小編,將免費陪你一起解讀。
譯:BUB1B和circBUB1B_544 aa誘發染色體不穩定性加重多發性骨髓瘤惡性腫瘤
signal transduction and targeted therapy ( IF :18.182/Q1 )
複製點選此處直達原文:https://www.nature.com/articles/s41392-021-00746-6
結論放前邊講:
◆ 在結論上,作者發現了:
BUBIB中存在circBUB1B_544 aa(一個由circBUB1B編碼的多肽),且BUB1B激酶催化中心是由這個circRNA來翻譯的,MM外周血circBUB1B_544 aa升高與MM預後不良密切相關,與BUB1B對染色體不穩定(CIN)的誘發有協同作用。
◆ 在機制上,作者發現了:
BUB1B主要透過磷酸化CEP 170 Ser1260位點與CEP 170直接相互作用來誘發CIN,導致MM不良。此外,MM細胞還能分泌circBUB1B_544 aa,並以與BUB1B全長蛋白相同的方式干擾MM微環境細胞。
◆ 在研究意義上,作者認為:
BUB1B siRNA靶向BUB1B和circBUB1B_544 aa的激酶催化中心,在體外和體內均能顯著抑制MM的惡性。BUB1B和circB1B_544 aa是MM的預後和治療靶點。
說人話就是,對於MM,BUB1B和circB1B_544 aa兄弟兩都不是什麼好東西!
一段話概況全文:
本研究中,作者首先確定了circBUB1B是可翻譯的,並編碼了一個新的異構體,circBUB1B_544 aa。從BUB1B基因第6外顯子與第8外顯子共價連線所形成的跨越連線ORF中,circBUB1B_544 aa具有明顯的氨基酸序列,與線性mRNA翻譯蛋白相比,含有BUB1B激酶催化中心。
其次,circBUB1B_544 aa和BUB1B透過啟用CEP 170在MM中發揮協同作用促進MM細胞增殖和耐藥。
此外,MM細胞分泌circBUB1B_544 aa,影響MM微環境中相鄰或遙遠的細胞。BUB1B和circBUB1B_544 aa的下調對MM細胞的體外和體內生長均有抑制作用。
總之,BUB1B激酶催化中心是MM的潛在治療靶點,抑制該催化中心不僅能抑制CIN誘導的MM細胞增殖和耐藥,而且能阻斷BUB1B和circBUB1B_544 aa在微環境中的細胞相互作用。
好了,話到這裡重要的資訊已經傳達完了,如果還想進一步瞭解研究方法和結果~~~~
我們來過一下這篇文章的結果
1.BUB1B在MM中的高表達與生存不良相關
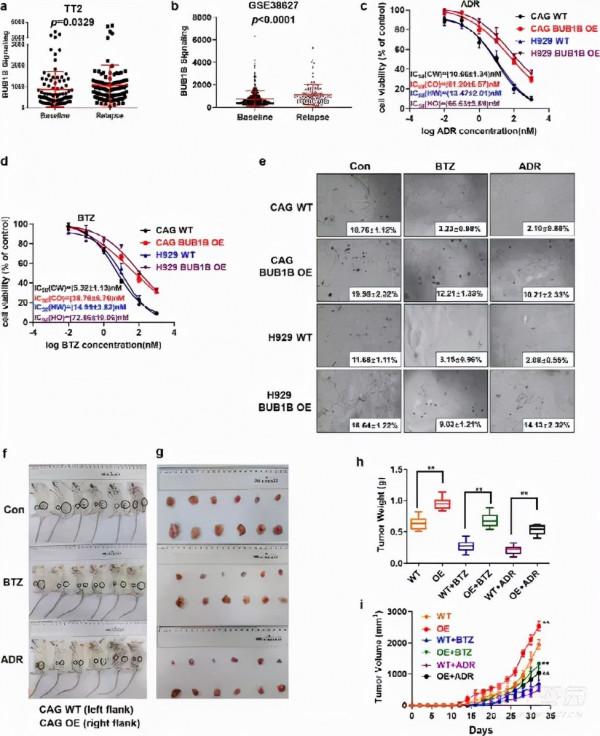
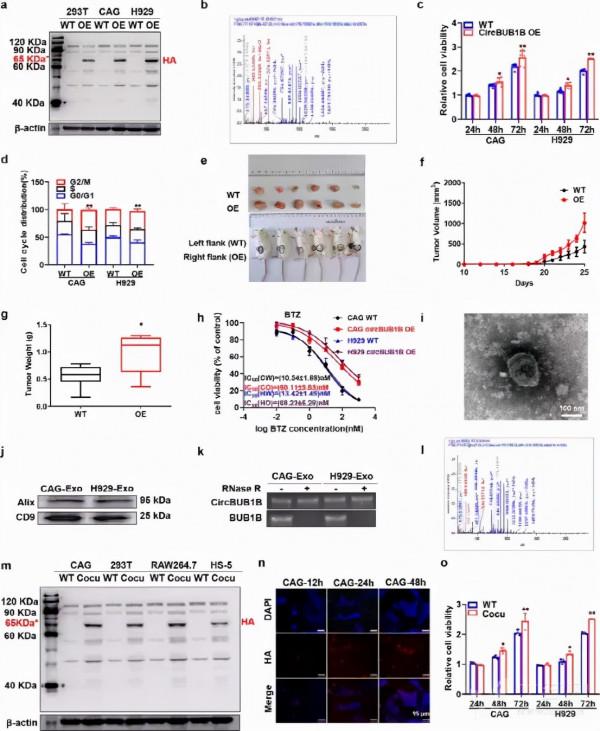
為探討BUB1B在MM發病中的作用,對正常血漿(NP)、臨床意義不明的單克隆Gammopathy(MGUS)、多發性骨髓瘤(SMM)、多發性骨髓瘤(MM)和複發性多發性骨髓瘤(RMM)的GEP資料進行初步分析。BUB1B在MM細胞中的表達顯著升高(n=69)和RMM(n=28)病人,與NP比較(n=15),MGUS(n=22)和SMM(n=24)(p < 0.0001) (Fig. 1A)。值得注意的是,BUB1B的表達與HOVON 65(p < 0.0001) (Fig. 1B)和TT2(p < 0.0001) (Fig. 1C)患者佇列,提示BUB1B是MM預後不良的潛在生物標誌物。
2.BUB1B促進MM細胞增殖和克隆擴增
為了確定BUB1B是否是MM細胞增殖的真正驅動基因,BUB1B透過慢病毒轉染在MM細胞中被過表達(OE)。1D)。MTT法顯示,BUB1B-OE細胞中CAG和H 929細胞的增殖率呈時間依賴性增加(P<0.05)。p < 0.001) (Fig. 1E)。BUB1B被BUB1B靶向shRNAs擊倒(KD),WB檢測CAG和H 929細胞的KD效率。1F)。BUB1B-KD MM細胞的生長速度明顯低於對照組(Ctrl)。p < 0.01) (Fig. 1g)。結果表明,BUB1B對MM細胞增殖有促進作用。此外,細胞週期分析表明,BUB1B的強制表達引起G2/M期比例的顯著增加。p < 0.01) (Fig. 1H,BUB1B表達減弱導致MM細胞G2/M期比例顯著降低(p < 0.01) (Fig.1J,k)。克隆形成軟瓊脂分析顯示,OE或KD BUB1B顯著改變MM細胞的長期自我更新,表現為CAG和H 929細胞克隆形成明顯增加或減少。1L)。這些發現進一步支援了BUB1B促進MM細胞生長的觀點。
3.上調BUB1B誘導MM耐藥
由於作者先前的研究表明BUB1B在高風險MM亞組中富集,與復發和耐藥密切相關,作者進一步測定了BUB1B在復發MM標本中的表達。分析表明,與新診斷組相比,TT2和GSE 38627組復發MM標本BUB1B表達增高(p <0.05)< span="">Fig.2A,b)。為了進一步探討BUB1B與耐藥的相關性,作者採用MTT法對IC進行了評價。50BUB1B WT和OE細胞的BTZ和ADR。整合通路50BUB1B-OE細胞的BTZ和ADR均顯著高於WT細胞(p < 0.001) (Fig. 2C,d)。此外,採用BUB1B OE和WT細胞(CAG&H 929)經ADR和BTZ處理後,進行克隆性軟瓊脂檢測。與對照組相比,在相同濃度的ADR和BTZ處理下,BUB1B-OE細胞的克隆形成明顯多於WT細胞。2E)。為擴大這些觀察範圍,將CAG BUB1B WT或OE細胞分別皮下注射NOD-SCID小鼠的右側或左側,分別給予ADR或BTZ治療。32天后,作者觀察到來源於BUB1B的腫瘤。-OE細胞的生長速度明顯快於從WT細胞衍生出來的腫瘤(Fig.2F,g)。同時,平均體重和體積也顯著高於同齡人(Fig 2H,i)。此外,使用ADR或BTZ治療的WT腫瘤落後於其相應的未治療對照組.而BUB1B-OE組經上述藥物治療後腫瘤生長速度無顯著性差異(Fig 2H,i)。因此,BUB1B-OE細胞在體內對ADR和BTZ均表現出潛在的耐藥性,而WT細胞對ADR或BTZ的治療敏感。該資料有力地支援BUB1B是促進MMM耐藥的重要因素。
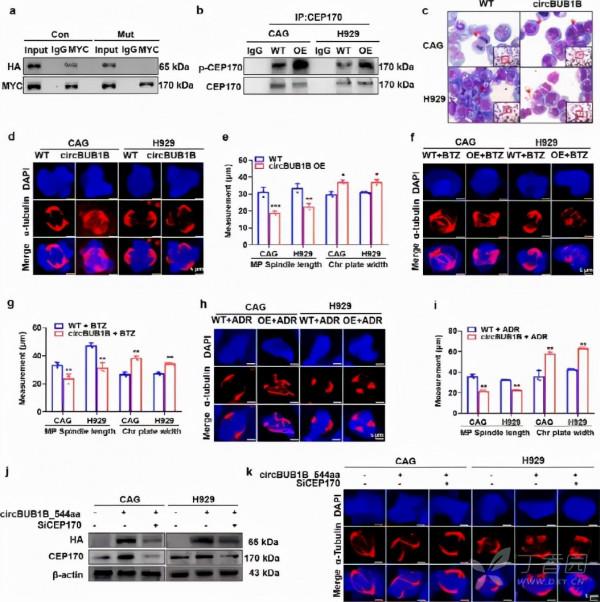
4.BUB1B啟用MM細胞CEP 170誘發染色體不穩定性(CIN)
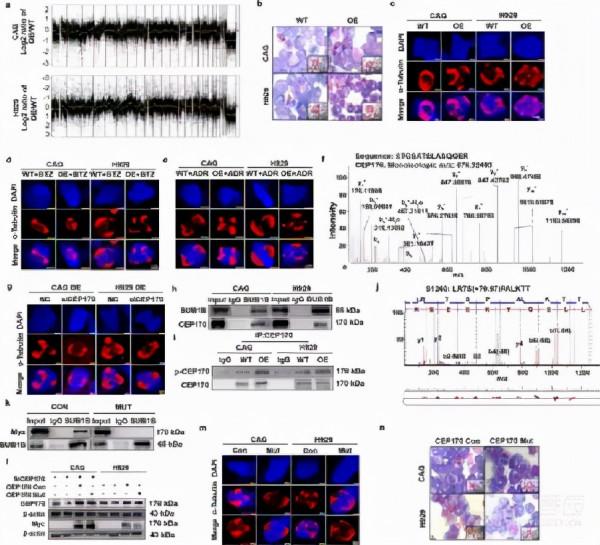
因為BUB1B參與調節有絲分裂紡錘體檢查點(SAC),以確保在分裂過程中染色體的正確分離,以保持基因組的穩定性,作者旨在確定BUB1B是否促進MM CIN,以進一步闡明BUB1B在MM生物學中的作用。作者首先進行了比較基因組雜交(CGH)陣列,從基因組水平評價BUB1B對MM染色體組成的影響。資料表明,BUB1B-OE、CAG和H 929細胞中的多個染色體片段相對於相應的WT細胞有明顯的得失(Fig.3A)。病理Giemsa染色顯示BUB1B的過表達對CIN的兩項指標有明顯的促進作用,多核細胞數(p <0.05)以及mm細胞的分離錯誤率(< span="">Fig.3B,補充圖。1A)。第三,染色體板寬度和有絲分裂雙極紡錘體長度是CIN的另一個主要特徵。用免疫熒光染色法檢測α-微管蛋白和dapi,結果表明BUB1B的上調明顯增加了染色體板的寬度。p <0.05)和減少有絲分裂雙極紡錘體長度(p <0.001)在mm細胞中。3c,補充圖。1b),表明bub1b的擴增促進了cin的發生。由於cin與腫瘤耐藥密切相關,< span="">作者評價了BUB1B-OE能否克服MM細胞對BTZ或ADR的敏感性。IF染色結果表明,BUB1B-OE在BTZ或ADR處理後,對WT細胞的染色體板寬度明顯增大,有絲分裂紡錘體長度減少。p <0.05)< span="">(Fig.3D,e,補充圖。1C,d)。以上資料為BUB1B誘導的CIN在MM中的耐藥機制提供了依據。
為了闡明BUB1B對CIN的影響機制,對BUB1B下游靶點進行了Co-IP分析和質譜(MS)檢測,並在BUB1B與BUB1B相互作用的蛋白質中鑑定了中心體蛋白170(CEP 170)。3F)。CEP 170是一箇中心體成分,負責中心體微管的錨定。BUB1B與CEP 170在BUB1B、OE、CAG和H 929細胞上的物理相互作用均得到證實。3H)。另外,siRNA靶向BUB1B-OE CAG和H 929細胞可降低BUB1B誘導的CIN特徵,提示BUB1B透過與CEP 170直接相互作用而誘導MM發生CIN。第三代).
由於BUB1B作為激酶,作者認為BUB1B可以磷酸化CEP 170。共ip分析證實了作者的假設,並表明BUB1B-OE CAG和H 929細胞中磷酸化形式的CEP 170與WT細胞相比有增加的趨勢(圖一)。3I)。此外,MS分析還發現CEP 170 Ser1260是BUB1B的磷酸化位點。3J)。為了進一步證明CEP 170 Ser1260是BUB1B磷酸化位點,作者將Ser 1260突變為ALA。突變體Ser1260AlaCEP 170與BUB1B的相互作用較對照組明顯抑制(Fig.3K)。作者進一步轉染WT並將CEP 170質粒突變到MM細胞中,內源性CEP 170被敲除。3L)。有趣的是,作者發現突變的Ser1260AlaCEP 170可以影響CIN,這表現在染色體板寬減少,有絲分裂紡錘體長度比WT細胞增加(Fig.3M,補充圖。1E)。Giemsa染色顯示Ser1260Ala突變型CEP170OE細胞的多核細胞數較WT細胞減少。Fig.3n,補充圖。1F,g)。綜上所述,這些發現揭示了BUB1B透過在Ser1260位點磷酸化CEP 170來誘導MM CIN。
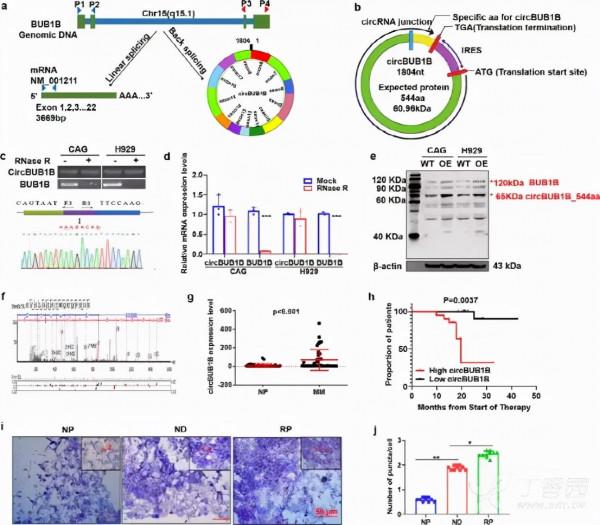
5.CircBUB1B_544 aa是一種具有蛋白質編碼能力的circRNA
骨髓微環境對MM細胞的抑癌生長有著極其重要的作用,人們對circRNA對MM微環境的影響進行了進一步的研究。作者首先利用circ資料庫預測了一個含有13個外顯子的分泌型BUB1B有circRNA片段(1804 Bp)的存在。4A),含有一個推測的核心糖體進入位點(IRES)序列,並可能編碼一個新的BUB1B亞型,含有544個氨基酸(Fig.4B),在本研究中稱為“CircBUB1B_544 aa”。為證實BUB1B基因第6外顯子和第18外顯子形成內源性circRNA,設計了聚合引物和發散引物分別檢測BUB1B mRNA的線性型和環狀。RNase R消化後,線性形態顯著降解(p <0.001),< span="">circBUB1B表現出抗性,證實了circBUB1B的存在(Fig.4C,d)。接下來,Sanger測序確認了circBUB1B連線位點(Fig.4C),進一步證實了CircBUB1B的存在。然後,作者利用BUB1B抗體成功地鑑定了CircBUB1B_544 aa在CAG細胞和H 929 BUB1B-OE細胞中的升高,從而特異性地識別了BUB1B的N-末端(Fig.4E)。MS分析進一步驗證了circBUB1B_544 aa的特異性肽片段。4F)。綜上所述,作者的資料證明了一個分泌的circBUB1B RNA片段的存在,並證實了它的蛋白編碼能力,稱為circBUB1B_544 aa。
為了加強在MM原發樣本中的發現,作者收集了48例MM患者和48名健康對照者的血液樣本。有趣的是,circBUB1B在MM患者中比健康對照組多得多(p < 0.001) (Fig. 4G高表達的MM患者EFS存活率顯著低於正常對照組(P<0.05)。p <0.01)(< span="">Fig.4H)。作者進一步對MM患者標本的組織晶片進行了RNA範圍分析,以檢測circBUB1B的存在。結果表明,復發患者(RP)組織中CircBUB1B的丰度顯著高於配對的初診患者(ND)和正常組織(Np)。Fig.4i,j),提示CircBUB1B可能是MM進展的潛在生物標誌物。
6.CircB1B_544 aa促進MM細胞增殖及耐藥性
為了鑑定circBUB1B_544 aa的功能,作者將circBUB1B_544 aa的序列插入到帶有HA標籤的質粒中,表達了過表達的circBUB1B_544 aa。其次,HA抗體和MS分析進一步證實了circBUB1B_544 aa的特異性肽片段(Fig.5A,b)。Fig.5C,circBUB1B的升高促進了CAG和H 929細胞的增殖。p <0.05)。細胞週期分析還顯示,CAG和H 929週期BUB1B-OE細胞的G2/M期細胞比例明顯增加。5D)。作者進一步評估了circBUB1B對MM體內增殖的影響。將CAG WT細胞和circBUB1B-OE細胞分別皮下注射NOD-SCID小鼠左右兩側。circBUB1B-OE細胞形成的腫瘤生長速度快於WT細胞,腫瘤重量和體積明顯增加(P<0.05)。p < 0.05) (Fig. 5E-g)。類似於BUB1B的探索,作者評估了circBUB1B OE是否能克服MM細胞對BTZ或ADR的敏感性。MTT法顯示circBUB1B-OE細胞具有較高的IC活性。50與WT細胞相比,BTZ和ADRp < 0.001) (Fig. 5H,補充圖。2A).
7、MM細胞分泌BUB1B_544 aa對BM微環境中對應細胞的影響
眾所周知,BM微環境對MM細胞的致癌生長起著至關重要的作用,許多研究透過細胞間通訊來探討circRNA對BM微環境的影響。12環RNA在外胚層中具有豐富和穩定的特性,可作為腫瘤檢測和向受體細胞轉移生物學活性的潛在生物標誌物。22作者從CAG和H 929細胞的培養上清液中提取了外顯子,並用TEM法對其進行了鑑定。5I)和WB分析兩個標記的Alix和CD9。5J)。如預期的,circBUB1B在外顯子中透過qPCR檢測到(Fig.5K)。為了研究circRNA透過細胞間通訊對MM微環境的重要影響,作者利用Transwell將野生型CAG、293 T、RAW、HS-5細胞與CAG circB1B-OE細胞共培養。作者發現所有共同培養的細胞,如HA抗體檢測到的circBUB1B_544 aa。5M)。此外,MS分析證實了circBUB1B_544 aa的特異性肽片段。5L)在共培養細胞中,提示分泌circBUB1B_544 aa可透過MM微環境干擾鄰近或遠處細胞。此外,CAG WT和CircBUB1B-OE細胞共培養12 h、24 h、48 h,HA和DAPI染色顯示CAG共培養細胞的表達呈時間依賴性。5N)。Fig.5o共培養的CAG細胞和H 929細胞的增殖率呈時間依賴關係(P<0.05)。p < 0.01) compared to the non-cocultured WT cells. MTT assay confirmed that higher IC50共培養CAG和H 929細胞的BTZ和ADR均高於WT細胞(Fig.2B,c)。總之,作者現在的結論是MM細胞分泌circBUB1B_544 aa來影響BM微環境中的對應細胞。
8.CircB1B_544 aa透過CEP 170在MM細胞中啟用CIN
為了證實circBUB1B_544 aa的激酶功能,作者首先透過Co-IP實驗證實了circBUB1B_544 aa與天然CEP 170有強烈的相互作用,而在突變型CEP 170細胞中,這種相互作用受到了破壞。6A)。與WT細胞相比,circBUB1B_544 aa-OE細胞的CEP 170磷酸化增強。6B)。Giemsa染色結果表明,circBUB1B_544 aa的上調導致更高的分離錯誤率和多個核細胞的數目。p <0.01)在CAG和H 929細胞中的表達。6C,補充圖。2D,e)。IF染色顯示circBUB1B_544 aa的升高顯著增加了染色體板的寬度(p <0.05)和< span="">減少有絲分裂雙極紡錘體長度(p <0.01)(< span="">Fig.6d,e)。在此基礎上,作者進一步測試了circBUB1B_544 aa OE是否能克服BUB1B對MM細胞的BTZ或ADR的敏感性。IF染色結果表明,與WT細胞相比,circBUB1B_544 aa OE使CAG和H 929細胞的染色體板寬度顯著增加,有絲分裂紡錘體長度減少(P<0.05),提示CircB1B_544 aa能誘導CIN誘導MM耐藥,BUB1B也能促進BUB1B的耐藥。6f-i)。為了確定CIN的存在需要CEP 170與circBUB1B_544 aa相互作用,作者用siRNAs方法將CIN 170敲除。6J)。作者發現circB1B_544 aa OE細胞中CEP 170的敲除可使MM細胞的CIN消失,表現為染色體板寬度的減少和有絲分裂紡錘體長度的增加。6K,補充圖。2F)。綜上所述,這些發現揭示了BUB1B的circBUB1B_544 aa可以磷酸化CEP 170誘導CIN。
9.BUB1B和circBUB1B_544 aa誘導下調對MM細胞生長的抑制作用
為了驗證BUB1B和CircBUB1B_544 aa是否是有前途的MM治療靶點,設計了三個siRNA片段,分別針對circBUB1B_544 aa和其線性對應物的激酶催化中心序列。7A)。WB分析顯示轉染siRNA-3(si-3)可同時降低BUB1B和circB1B_544 aa的表達,並將其應用於後續研究。7b)。MTT法顯示,阻斷BUB1B和CircB1B_544 aa可明顯抑制CAG和H 929細胞的增殖。p < 0.01) (Fig. 7C)。與流式細胞儀檢測的WT細胞相比,BUB1B和CircB1B_544 aa-si-3細胞在G2/M期明顯下降。7D)。最重要的是,siRNA靶向BUB1B和CircBUB1B_544 aa可明顯抑制NOD-SCID小鼠的腫瘤生長。7e-h)。SiBUB1B和circBUB1B_544 aa細胞形成的腫瘤生長速度比NC細胞慢,腫瘤重量和體積明顯減少。p < 0.01). 總而言之,這些發現表明circBUB1B_544aa透過誘發CIN和誘導耐藥性來加重MM。(Fig. 7I)。靶向BUB1B和CircBB1B_544 aa可能為MMM提供一種有吸引力的治療方法。
好,今天的文獻解讀就到這裡
下期繼續解讀新文獻
記得關注我哦,麼麼麼[吻][飛吻][吻]