奇點糕被各個遊戲中的刺客形象所深深吸引,總是不禁腦補:刺客是不是身上揹著哆啦A夢,想要多少武器,飛鏢匕首子彈啥的,都能給扔出來,然後就可以旋轉跳躍不停歇,完成刺殺行動。
在我們的免疫系統裡,殺傷性T細胞(CTL)也是刺客一般的存在,它們不僅能夠高效、精準地解決入侵者,還能夠保持持續、高昂的戰鬥狀態,透過分泌穿孔素、顆粒酶B、IFN-γ、TNF-α等細胞因子來擊殺入侵的病原體或受損的細胞[1,2]。
那麼,又是誰保證了殺傷性T細胞的持續殺傷能力呢?
近日,一篇發表在頂級期刊《科學》上的文章提出,單個殺傷性T細胞能持續作戰,竟是依賴於線粒體的翻譯能力,而不是線粒體提供的能量[3]!
來自劍橋大學的Gillian M. Griffiths帶領她的團隊發現,線粒體翻譯透過調控穿孔素、顆粒酶B、IFN-γ、TNF-α等殺傷關鍵因子的合成,來保證CTL的殺傷持續性。如果線粒體翻譯受損,則會導致CTL的持續殺傷能力缺陷。
我們都知道,細胞裡的線粒體屬於“帶資進組”,有自己的一套遺傳系統,包括線粒體基因複製、轉錄、翻譯等,線上粒體基因和核基因的共同調控下執行功能,是細胞不可或缺的一部分。
線上粒體外膜上存在一種去泛素化酶——USP30。酶如其名,USP30能夠抑制泛素化作用,防止線粒體被細胞的自噬行為“誤食”[4]。而有研究發現,USP30還能夠調控CTL的殺傷功能[5]。
Griffiths和她的團隊便想到,目前還沒有研究提出線粒體在CTL殺傷功能中扮演了什麼角色。那會不會正是由於USP30的缺失,使得細胞內線粒體缺陷,才影響了CTL殺傷能力?
於是,研究者們從USP30缺失型小鼠出發,對線粒體和CTL殺傷功能之間的關係一探究竟。
他們發現,和野生型小鼠相比,雖然USP30缺失小鼠的T細胞依舊能正常分化成CTL,但在大多數(92%)CTL中,線粒體數量都有所減少、形態發生改變,主要的氧化磷酸化等功能也明顯受損。

左:野生型CTL的線粒體正常;右:USP30缺失的CTL中,線粒體受損
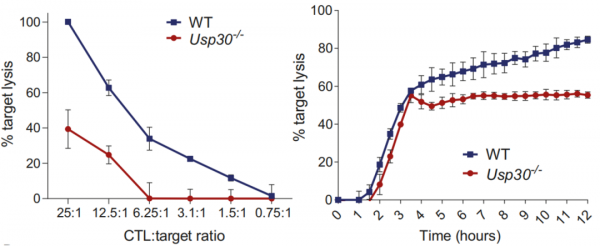
不僅如此,USP30缺失的CTL還有持續性殺傷的缺陷。如果需要進行長時間殺傷或是CTL數量有限,殺敵就頗為吃力。
在短期殺傷實驗中,當CTL與靶細胞的數量比超過25:1時,USP30缺失的CTL僅能殺死40%的靶細胞,而正常CTL卻能殺死全部靶細胞。
在長期(12h)殺傷實驗中,當CTL與靶細胞數量比為1:1時,USP缺失的CTL在前4個小時還能與正常CTL的殺傷能力抗衡,但隨後卻無法進一步殺傷靶細胞。說明USP30缺失的CTL會隨著時間推移失去殺傷能力。
也就是說,USP30缺失並沒有耽誤T細胞成為一名刺客,只不過線粒體出了點兒小問題,而且削弱了CTL殺傷的持續性。
所以,線粒體的這點兒問題,是如何影響到CTL的持續殺傷能力的呢?
在大多研究中,線粒體都是以“能量工廠”的身份出現,透過能量供應和氧化損傷等來影響細胞的某些功能。出乎意料的是,在UPS30缺失引起線粒體異常的情況下,CTL的總ATP水平並沒有擾動,CTL的運動、極化、訊號傳導和分泌等行為也沒受到影響。
受損的竟是穿孔素、顆粒酶B、IFN-γ、TNF-α等殺傷關鍵細胞因子的翻譯過程!
Griffiths和她的團隊發現,USP30缺失並沒有引起CTL中殺傷因子相應的mRNA水平變化,只是翻譯過程存在異常。而一旦這些殺傷因子的蛋白合成受到抑制,就會削弱CTL的殺傷持續性。
令人驚訝的不止這一點。這些殺傷因子都是胞質蛋白,然而根據蛋白質組分析,USP30缺失的CTL中,胞質核糖體是完好無損的;另一方面,USP30缺失主要引起線粒體蛋白的水平下降,其中,線粒體核糖體蛋白的水平下降幅度最大。

在USP30缺失的CTL中,表達水平顯著下降的蛋白質。線粒體蛋白佔主要
這麼來看,這些殺傷關鍵因子的合成可能是受線粒體翻譯功能的影響。
進一步用強力黴素(doxycycline,DOX)選擇性抑制正常CTL中的線粒體翻譯時,果真1小時後便檢測到這些殺傷因子的翻譯過程被抑制,4個小時後CTL出現殺傷力減弱。
這也就意味著,是線粒體翻譯保證了穿孔素、顆粒酶B、IFN-γ、TNF-α等殺傷武器及時裝填,成為CTL能夠持續殺敵的重要保障。
至於線粒體翻譯具體是如何調控這些胞質蛋白翻譯過程的,研究者們發現,由於USP30缺失導致表達水平下調的蛋白質中,有68%參與細胞代謝。其中包括一些能與RNA結合的代謝酶(RBPs),這些RBPs已經被證明能夠對穿孔素、顆粒酶B、TNF-α、IFN-γ等殺傷因子進行轉錄後調控[6,7]。
對此他們提出,當線粒體翻譯受損時,這種代謝重組導致了殺傷關鍵因子的選擇性減少。
總體來說,研究者們發現了單個殺傷性T細胞就能夠持續作戰的秘密。
穿孔素、顆粒酶B、TNF-α、IFN-γ等細胞因子是殺傷性T細胞用於殺傷的武器,而線粒體翻譯能夠調節這些殺傷關鍵因子的合成,為殺傷性T細胞的武器供應提供保障,從而進行持續性殺傷。
殺傷性T細胞為何能持續不斷地進行殺傷,算是有了定論。
而關於遊戲裡刺客的秘密,奇點糕也早有自己的定論——其實刺客的斗篷裡住著會做武器的手藝人!
[1]P. Golstein, G. M. Griffiths, An early history of T cell-mediated cytotoxicity. Nat. Rev. Immunol. 18, 527–535 (2018)
[2]A. Wiedemann, D. Depoil, M. Faroudi, S. Valitutti, Cytotoxic T lymphocytes kill multiple targets simultaneously via spatiotemporal uncoupling of lytic and stimulatory synapses. Proc. Natl. Acad. Sci. U.S.A. 103, 10985–10990 (2006).
[3]Lisci M, Barton PR, Randzavola LO, Ma CY, Marchingo JM, Cantrell DA, Paupe V, Prudent J, Stinchcombe JC, Griffiths GM. Mitochondrial translation is required for sustained killing by cytotoxic T cells. Science. 2021 Oct 15;374(6565):eabe9977.
[4] N. Nakamura, S. Hirose, Regulation of mitochondrial morphology by USP30, a deubiquitinating enzyme present in the mitochondrial outer membrane. Mol. Biol. Cell 19, 1903–1911 (2008).
[5] L. Abeler-Dörner et al., High-throughput phenotyping reveals expansive genetic and structural underpinnings of immune variation. Nat. Immunol. 21, 86–100 (2020).
[6]M. Turner, M. D. Díaz-Muñoz, RNA-binding proteins controlgene expression and cell fate in the immune system. Nat.Immunol. 19, 120–129 (2018).
[7]F. Salerno, M. Turner, M. C. Wolkers, Dynamic posttranscriptional events governing CD8+ T cell homeostasis andeffector function. Trends Immunol. 41, 240–254 (2020).