上節課我們就說完了原子核的發現過程,盧瑟福也因此建立了一個行星原子模型,這個模型只是初步的給人們描述了一個原子的影象,就像是八大行星繞著太陽旋轉一樣。
不過在這個模型中還存在很多的問題,還有困難,比如原子核的核電荷數是多少?原子核的組成成分是啥?原子的穩定問題以及核外電子的排布問題?
透過解決以上的問題,物理學就出現了兩個大的分支,研究原子核及其組成分成的就叫核物理,以及後來又衍生出的粒子物理,研究原子穩定性的問題,以及核外電子排布的,就是舊量子論。
舊量子論的主要內容就是玻爾的量化原子模型,這些內容在我之前的量子力學中已經講過了,那今天我們要說的核電荷數的測量,其實嚴格來說又跑題了,因為在之前的量子力學中我已經說了一遍了。
不過,我覺得在今天的這個系列中還是有必要要再說一下,因為這是盧瑟福發現原子核遺留下來的問題,好,那閒話就不多說了,開始今天的正題。
盧瑟福在發表了自己的原子模型以後,有一次在劍橋大學卡文迪許實驗室的晚宴中就遇見了尼爾斯·玻爾,玻爾這個時候還是學生,他專門從丹麥來英國的劍橋找自己的偶像湯姆遜。
但兩個人的見面並不愉快,正好這時玻爾遇見了盧瑟福,兩人就聊得挺投緣的,所以在玻爾的心裡就萌生了一個想法。那到了1912年,玻爾就離開劍橋,去曼徹斯特投奔了盧瑟福。
在盧瑟福這裡玻爾就學到了最新、最前沿的原子物理,也抓住了一個重要的研究題目,盧瑟福原子模型的穩定性問題。
在1913年玻爾就發表了三篇論文,透過量化電子軌道角動量,也就是量化了電子在核外所能佔據的軌道大小,就解釋了原子穩定性的問題。
同時也解釋了原子光譜的來歷,就是核外的電子在不同能級之間的躍遷形成,為了驗證自己的想法, 玻爾就推匯出了一個公式,透過這個公式我們就能知道,電子從第一激發態躍遷回基態的時候,所釋放的電磁波的波長,正比於核電荷數。
因此我們只需要測量電磁波的波長,就能算出核電荷數了。這個測量的工作是由盧瑟福團隊的亨利·莫斯萊完成的,玻爾他不是實驗物理學家,自己做不了實驗,在論文發表以後,同年的7月份玻爾就專門去找了莫斯萊,讓莫斯萊趕緊測,因為當時反對他的原子模型的人挺多了,主要是玻爾解釋不了為什麼電子在核外只能佔據特定的能級?所以當務之急就是用實驗證明他的理論沒有問題,那至於為什麼,以後再慢慢解釋也來得及。
亨利·莫斯萊就覺得這個題目還不錯,而且他當時正在實驗室學習如何利用晶體替代衍射光柵測量X射線的波長,因為X射線經過晶體以後會發生偏轉,這偏轉的程度就跟X射線的波長有關。
那亨利·莫斯萊的實驗是這樣的,他選用了一些中等相對質量的原子進行測量,因為這些原子核電荷數不高也不低,可以釋放出波長比較合適的X射線。
那根據玻爾的理論,只要我們用大量的能量足夠的電子去轟擊金屬原子,總有可能會發生這些金屬原子基態電子會被撞出來的可能,那基態沒有了電子,第一激發態的電子就要往回躍遷,然後釋放出一個X射線光子,攜帶兩個能級之間的能量差。
透過測量釋放出來的X射線波長,然後根據玻爾給出的公式就能算出每種元素原子的核電荷數了。
那經過莫斯萊兩個月的辛苦工作,測量的結果就在同年9月份發表了出了,這個實驗不僅驗證了玻爾的量化原子模型,還順帶測量出了原子核的電荷數,提出了原子序數的概念,理清了元素週期表中元素的排列問題。
同時莫斯萊還預言了四種沒有被發現的元素,分別是42、43、72、75,那後來這些元素都被發現了,可惜莫斯萊卻在1915年死在了一戰的戰場,不然的話,他的實驗足以讓他獲得諾貝爾獎。
現在我們看到的就是當時亨利·莫斯萊測量出來的原子核的電荷數,可以看出,從鈣到鋅,核電荷數基本上就是電子電荷的整數倍,那多出來的一點點可以解釋為實驗的誤差。
整數倍正好就說明了,原子核所攜帶的電荷正好抵消了電子的電荷,物質才表現出了電中性,這一點跟人們之前的猜測是完全一樣。
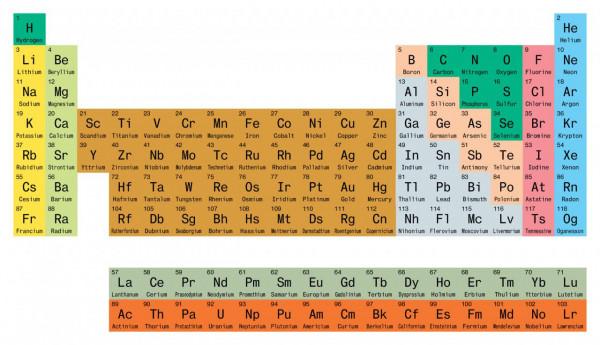
不過神奇的是,每一個元素到相鄰的下一個元素,不管他的相對原子質量增加了多少,他的核電荷數就只增加一個單位,所以莫斯萊就發現,元素原子的核電荷數正好就等於它在元素週期表中的位置序數。
這就是原子序數的概念,這對我們理解元素週期來說至關重要,有了原子序數的概念,我們就知道元素的化學性質是由核電荷數來決定了,而且核電荷數也決定了核外電子的數目。
由於以前人們並不知道元素原子的排列順序是跟核電荷數相關的,而是根據元素的相對原子質量排列的。
所以在這之前,人們發現了同位素以後,這些同位素和已知元素的化學性質相同,但是相對原子質量卻不同,當時就把元素週期表搞的混亂不堪。
那莫斯萊發現了原子序數之後,就可以理清這個問題了,同位素的核電荷數一樣,核外電子數也一樣,所以化學性質相同,區別就是相對原子質量不同,以後我們在描述元素的時候,只要說清它的相對原子質量就可以區分這些同位素了。
所以說莫斯萊的發現,獲諾獎是完全沒有問題的,他的老師盧瑟福就非常惋惜地說,是莫斯萊逐一點了元素的名,揭示了元素週期表最後的秘密。
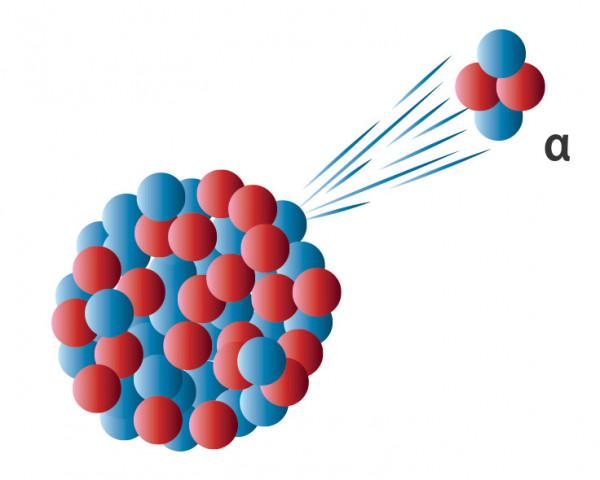
莫斯萊的發現還解釋了1911年索迪提出的元素位移定律,說的是,當一個放射性原子釋放一個α粒子以後,這個原子就會在按相對原子質量排列的週期表中下降兩個位置;
當一個放射性原子釋放出一個β粒子的時候,它就會在按相對原子質量排列的週期表中上升一個位置。
這就是放射性元素的位移定律,但當時並不能清楚地解釋這個問題,那莫斯萊發現的原子序數和核電荷數之間的關係,就可以簡單的說清這個問題了。
α粒子帶兩個核電荷,原子失去一個α粒子就是失去了兩個核電荷,所以它就會下降兩個位置,那β粒子帶一個負電荷,原子失去一個β粒子,肯定就會多出一個正電荷,所以元素就會向上移一個位置了。
從以上的描述中就可以看出,在1913年的時候,人們已經確認了這樣一個事實,放射性衰變產生的α粒子和β粒子是核現象,這對以後人們理解原子核的組成至關重要。
好了,今天的內容就到這裡,下節課我們說中子的發現。