ERBB家族成員的異常訊號在多種惡性腫瘤的發生發展中起重要作用。針對這些訊號通路的分子靶向藥物顯示出強大的臨床療效,但患者不可避免地會對這些分子靶向治療產生耐藥性。儘管免疫療法包括免疫檢查點抑制劑(ICIs)在多種癌症型別的患者治療中顯示出持久的抗腫瘤反應,但在含有一些基因改變的癌症中,如ERBB家族成員啟用的癌症中臨床療效有限,表明ERBB家族在抗腫瘤免疫逃逸中也有重要作用。試驗顯示對錶皮生長因子受體(EGFR)變異的非小細胞肺癌患者和HER2變異的乳腺癌患者進行ICI治療未能顯示出臨床益處,這表明EGFR和HER2訊號可能在抑制抗腫瘤免疫反應中起著重要作用。
近日日本科學家在Nature Reviews Cancer發表了關於ERBB受體家族訊號調控抗腫瘤免疫的綜述文章,討論了ERBB家族成員的訊號傳遞不僅影響自主性癌症發生發展的機制(如不受控制的細胞增殖),同時也研究了腫瘤微環境中的抗腫瘤免疫反應,以及免疫基因組精準醫學在免疫治療和以ERBB家族成員訊號為核心的分子靶向治療中的潛在應用。
ERBB家族訊號通路
ERBB家族包括ERBB1-4四個受體,即EGFR、HER2、HER3和HER4。如圖1,這四個受體可以形成同源或異源二聚體,不同受體有不同的配體,下游訊號通路相互聯絡和相互重疊。其中PI3K–AKT和MAPK通路是比較重要的訊號通路,另外還有PLCγ-PKC和 JAK2–STAT3訊號通路。
圖1. ERBB訊號通路
ERBB訊號通路對免疫細胞的影響
從免疫學的角度看,EGFR和HER2訊號通路可以抑制IFNγ的響應,進而抑制IRF和炎症性趨化因子的產生。EGFR訊號啟用一般會形成非炎症免疫微環境,EGFR訊號透過PI3K–Akt訊號與干擾素調節因子IRF1共同下調趨化因子配體CXCL10,導致效應CD8+T細胞減少。調節性T細胞(Treg細胞)透過JNK-JUN上調CC趨化因子配體22(CCL22)的表達,在EGFR突變癌症的非炎症TME中被招募。RAS–ERK、JAK2- STAT3和PI3K–AKT–NF-κB通路產生促腫瘤細胞因子cytokines和EGFR配體。此外,骨髓細胞中的EGFR訊號可誘導促腫瘤炎症,並導致EGFR配體(如HB-EGF)的表達增加。Treg細胞中的EGFR訊號阻止GSK3β降解FOXP3,增強Treg細胞的免疫抑制功能。
圖2. EGFR訊號通路在腫瘤微環境中對免疫細胞的作用
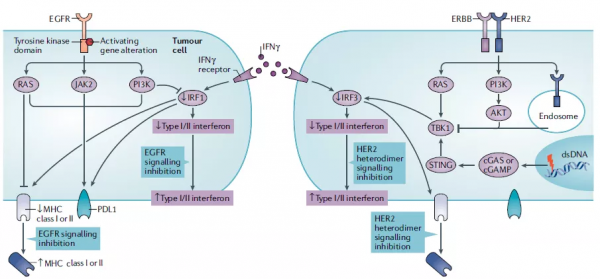
IFNγ的下調即IRF的下調可以直接抑制MHC-I的表達,與此同時PD-L1表達則被上調。MHC的下調進一步減弱了癌症的抗原性,減弱了免疫響應。如圖3所示,在EGFR突變的癌症中,PI3K–AKT途徑透過IRF1(MHC的轉錄因子之一)下調幹擾素訊號,RAS–RAF–MEK–ERK途徑也負性調節MHC的表達。EGFR突變癌症的PD-L1表達透過兩種相反的機制受到EGFR訊號的影響。在癌細胞中,PD-L1表達透過啟用PIK3–AKT、RAS–RAF–MEK–ERK和JAK2- STAT3途徑上調。另一方面,PD-L1的表達也透過IRF1訊號被γ干擾素(IFNγ)上調。在HER2擴增的癌症中,HER2誘導TBK1的去磷酸化並減弱干擾素基因(STING)訊號的刺激因子,導致干擾素訊號的損傷,特別是作為MHC的轉錄因子之一的IRF3的訊號損傷。抑制EGFR或HER2異二聚體訊號的分子靶向療法增加MHCⅠ類的表達和MHCⅡ類在EGFR突變和HER2擴增癌症中的表達。
圖3. EGFR變異和HER2擴增引起的癌症抗原性降低
ERBB訊號通路靶向療法與免疫療法的組合
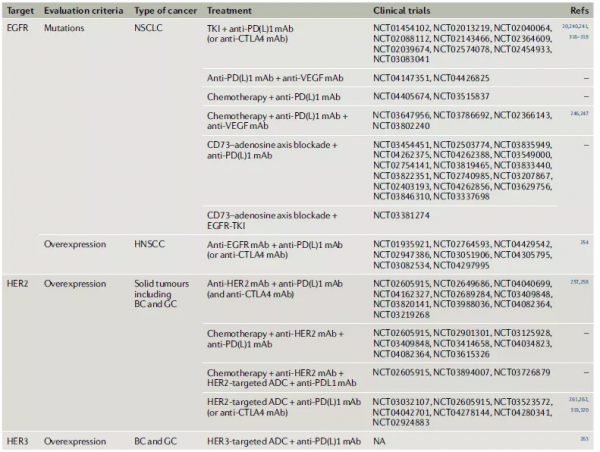
ERBB家族訊號,尤其是EGFR和HER2訊號,在促進腫瘤細胞增殖以及透過上述多種機制誘導免疫抑制性TME方面起著關鍵作用。由於EGFR突變造成了非炎症性的腫瘤微環境(TME),因此對PD-1/PD-L1等免疫檢驗點療法容易產生抵抗。既往的研究已經發現,PD-1抑制劑治療對EGFR野生型往往比EGFR突變型更有效。同時發現,PD-1等免疫檢驗點抑制劑對不同的EGFR突變的效果不同,因此對聯合治療的探索,特別是對細分突變型的分子機制的探索很有必要。目前有多種聯合療法在臨床試驗階段,包括ERBB通路靶向療法與免疫檢驗點、VEGF抗體、CD73抗體等(表1)。圖4結合免疫治療和分子靶向治療的概念,對ERBB家族訊號傳導的分子機制進行了闡述。
表1. ERBB家族訊號變異癌症的免疫療法聯合治療
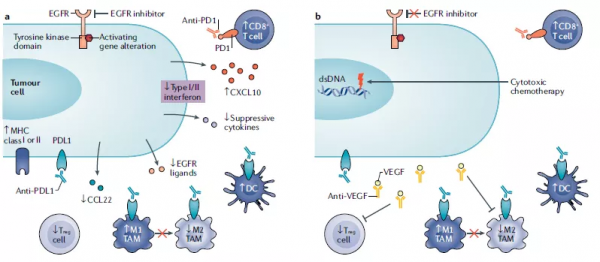
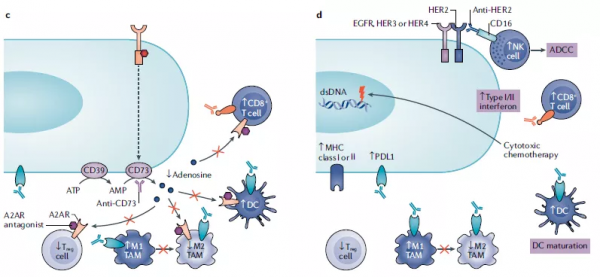
圖4a.用EGFR-TKIs(或單克隆抗體)抑制EGFR訊號可阻止免疫抑制細胞的浸潤並可能增強抗腫瘤反應。EGFR-TKIs促進癌細胞產生干擾素的和被效應T細胞招募的趨化因子如CXCL10,減少免疫抑制性的細胞因子和趨化因子,從而提高PD-1/PD-L1抑制劑的療效。圖4b. VEGF抑制劑是與ICIs聯合治療的選擇之一。ICIs與抗VEGF單抗聯合應用的療效提高可能歸因於免疫抑制細胞,特別是調節性T細胞(Treg細胞)的減少。這種聯合治療策略可能有益於對TKI耐藥的EGFR突變腫瘤的治療。圖4c. CD73單抗或A2AR拮抗劑可以抑制Treg細胞和骨髓源性抑制細胞(MDSCs)功能,增強樹突狀細胞(DC)和效應T細胞的活性。圖4d. anti-HER2 mAbs誘導抗體依賴性細胞毒性(ADCC),導致T細胞PD-1上調和腫瘤細胞PD-L1表達上調。抗體-藥物結合物(ADC)保留anti-HER2 mAbs的功能,誘導免疫原性細胞死亡及MHCI在癌細胞中的表達,導致DC成熟,與腫瘤相關巨噬細胞(TAMs)分化進入促炎M1型巨噬細胞並增加T細胞浸潤。
圖4. 靶向ERBB訊號通路的治療與免疫治療的組合療法
ERBB家族成員的異常訊號透過兩個方面促進腫瘤的發展:增強細胞生長和/或存活;透過直接調節免疫系統建立免疫抑制的腫瘤微環境,使腫瘤逃避抗腫瘤免疫反應。靶向異常ERBB家族訊號可能透過多種機制提高對ICIs的敏感性,包括上調腫瘤抗原呈遞、干擾和滅活免疫抑制細胞(如Treg細胞和MDSCs)以及下調免疫抑制分子。分子靶向治療與腫瘤免疫治療的聯合療法可以提高抗腫瘤療效,未來可能借由免疫基因組精確醫學開發出最佳的腫瘤治療方法。
ERBB受體靶向療法與免疫療法有複雜的cross-talk機制,因此在聯合療法的臨床開發策略上更為複雜。邁傑轉化醫學有成熟的ERBB通路與免疫訊號通路生物標誌物研究方案,幫助相關組合療法的新藥研發臨床試驗,歡迎垂詢[email protected]。
參考文獻:
Antitumour immunity regulated by aberrant ERBB family signaling. Nat Rev Cancer. 2021 Jan 18.