近日,Incyte公司在Journal for ImmunoTherapy of Cancer上報告了口服小分子PD-L1抑制劑INCB086550的I期(NCT03762447)臨床資料。據瞭解,這是首個口服小分子PD-(L)1人體試驗資料。
此項開放標籤研究納入的是晚期實體瘤成年患者(≥18 歲),這些患者接受標準療法後發生疾病進展或對標準療法不耐受、不適用。試驗首先採用的是改良的3+3劑量遞增方案,之後為劑量擴充套件方案。主要終點包括:INCB086550的安全性和耐受性,確定藥理活性劑量和/或MTD(最大耐受劑量)以及RP2D(II期臨床研究推薦劑量)。次要終點包括PK、藥效學,以及由研究者確定的ORR和DCR(CR、PR或SD≥12周)。
截至2021年4月9日,共有79例患者接受了INCB086550治療。其中57.0%為女性,62.0%接受過≥2線的既往治療,16%接受過IO(腫瘤免疫)治療。
結果顯示,68例療效可評估患者的ORR為11.8%(95%CI,5.2%–21.9%;CR,1.5%;PR,10.3%),DCR為19.1%(95%CI,10.6%–30.5%)。
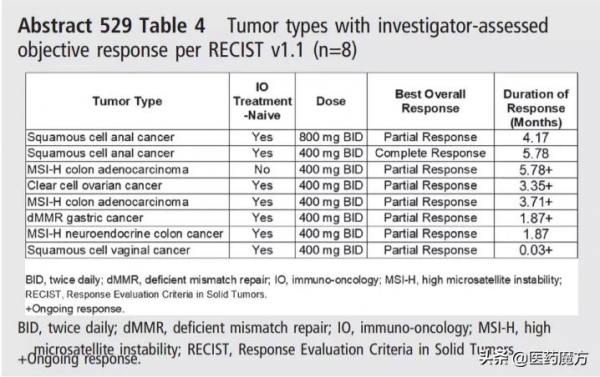
以下為不同瘤種出現客觀緩解具體情況。在劑量≥400mg BID時,8例患者出現客觀緩解。其中400mg BID中,5例未接受IO治療的MSI-H腫瘤患者中有3例出現客觀緩解。
在安全性方面,46例(58.2%) 患者出現與治療相關的TEAE(治療中出現的不良事件);10例 (12.7%) 出現≥3級治療相關TEAE。10例 (12.7%) 患者出現周圍神經病變TEAE,均≤3級,分別有21例(26.6%),5例(6.3%)和13例(16.5%)患者因TEAE而中斷治療、降低劑量、停藥。5例(6.3%) 患者死於TEAE,均被認為與研究藥物無關。
PD-1/PD-L1單抗存在很多缺點,如生產成本高、口服生物利用度缺乏、組織滯留時間長和膜透性較差等,而小分子抑制劑可以避免這些問題,是業界關注的一個重要方向。