近期,張運院士研究團隊在心血管病基礎研究領域取得了一系列重大進展,在《迴圈研究》(Circulation Research)《細胞死亡和分化》(Cell Death and Differentiation)《治療診斷學》(Theranostics)等國際期刊連續發表多篇高水平研究論文,受到國際學術界的高度關注。
動脈粥樣硬化性心血管疾病已成為我國人口死亡的首要病因。大量基礎和臨床研究證明,動脈粥樣硬化(AS)是一種慢性炎症性疾病,2017年發表的CANTOS臨床試驗將IL-1β確立為AS抗炎治療的關鍵靶點,使用IL-1β的單克隆抗體治療心肌梗死後患者取得了成功。NLRP3炎性小體是IL-1β的上游調控節點,NLRP3炎性小體活化可促進 IL-1β的產生,在AS炎症反應中起關鍵作用。NLRP3炎性小體的降解可負性調控NLRP3炎性小體的活化,深入探討 NLRP3炎性小體的負性調控機制,對於降低 IL-1β水平和干預AS的發生和發展具有重要意義。分 子 伴 侶 介 導 的 自 噬 (CMA)可針對性地介導細胞代謝過程中的一些關鍵蛋白質的降解,因而是一種特異和高效的蛋白質降解系統,但CMA能否調控NLRP3炎性小體的降解並在AS程序中發揮作用尚不明瞭。張運院士領導的課題組在ApoE-/-小鼠中建立了不同病程的AS模型,發現隨著AS斑塊的不斷進展,CMA的標誌物LAMP-2A表達量逐漸減少,在人體屍檢標本中觀察到同樣的現象。課題組構建了巨噬細胞 LAMP-2A基因特異性敲除小鼠以阻斷CMA的功能,結果顯示,與同窩CMA功能正常且病程相同的小鼠相比,CMA缺陷小鼠的主動脈弓及分支處斑塊數量明顯增多,主動脈根部的斑塊面積明顯增大,表明CMA缺陷可促進AS斑塊的進展。體外實驗證明,巨噬細胞CMA缺失可導致NLRP3炎性小體的啟用,進而活化半胱天冬酶 1,後者切割IL-1β和IL-18並使其活化,反之,將LAMP-2A轉入CMA缺失的巨噬細胞可明顯逆轉NLRP3炎性小體的活化程度。課題組在體外和體內實驗進一步證實,NLRP3蛋白是透過CMA途徑降解的,CMA缺陷導致NLRP3蛋白降解受阻,這是CMA調控NLRP3炎性小體活化的重要機制。該研究首次發現了CMA在AS發病機制中的作用,證明巨噬細胞CMA功能缺陷可增強 NLRP3炎性小體所介導的炎症反應,從而加速AS進展,上調CMA功能有望成為治療AS、肥胖、代謝紊亂綜合徵等慢性炎症性疾病的新途徑。
該研究發表於美國心臟學會主辦的心血管基礎研究領域的國際雜誌《迴圈研究》(Circulation Research,中科院一區,最新影響因子17.367),論文的第一作者是山東大學齊魯醫院心內科博士後喬磊和博士生馬靜,山東大學齊魯醫院張運院士和陳文強教授為該論文的共同通訊作者。山東大學齊魯醫院為第一和通訊作者單位。
高血壓腎病(HRD)是由原發性高血壓導致的腎臟結構和功能的損害,主要表現為蛋白尿增多、良性腎小球硬化、腎臟間質纖維化以及炎症細胞浸潤,但其發病機制尚不明瞭。泛素化修飾是一種重要的蛋白質翻譯後修飾,在多種疾病進展中發揮著關鍵作用。TRIM31屬於TRIM家族的一員,是一種重要的E3泛素連線酶。以往研究表明,TRIM31在先天免疫應答、NLRP3炎症小體的啟用、腸道菌群的組成以及腸道自噬中發揮著關鍵調控作用,TRIM31是否可透過其E3泛素連線酶功能影響HRD的疾病進展尚無報道。課題組在HRD患者的腎活檢標本中發現,隨著患者腎臟損傷和纖維化的進展,TRIM31的表達明顯下調, 在AngII輸注所致HRD小鼠模型的腎臟尤其是腎小管中,TRIM31的表達同樣明顯下調,提示HRD的進展可能與TRIM31在腎臟中的表達下調有關。為了探索TRIM31在HRD中的作用,課題組構建了TRIM31基因敲除小鼠(TRIM31-/-),在此組小鼠和同窩野生型小鼠中分別泵入AngII持續6周以構建HRD小鼠模型。結果顯示,AngII 誘導的 HRD 小鼠腎功能明顯損傷,TRIM31 基因缺失進一步加劇了AngII引起的小鼠腎功能損傷、腎臟濾過屏障損害、腎纖維化和炎症反應。為了進一步驗證TRIM31與AngII誘導的HRD之間的因果關係,課題組透過AAV9-TRIM31病毒注射上調小鼠腎臟中TRIM31的表達,同樣泵入AngII 持續6周以構建HRD小鼠模型,發現TRIM31過表達可緩解AngII誘導的小鼠腎損傷、纖維化和炎症反應。這些結果提示,TRIM31介導了AngII引起的小鼠HRD的病理損害。課題組深入的機制研究證實,TRIM31可負向調控 TGF-β1 介導的經典 Smad 訊號通路和MAPKs/NF-kB 訊號通路,其作用機制是直接降解蛋白激酶 MAP3K7。總之,該研究揭示了HRD發生和發展的新機制:HRD腎臟中TGF-β1表達升高,抑制 TRIM31 的表達,進而減少 MAP3K7 的蛋白降解,透過過度啟用的 Smad 訊號通路和 MAPK/NF-kB訊號通路,促進腎臟的纖維化及炎症反應。這些研究結果為 HRD 的治療提供了新的靶點。
該研究發表於Nature子刊《細胞死亡和分化》(Cell Death and Differentiation,中科院一區,IF:15.828),論文的第一作者是山東大學齊魯醫院心內科博士後張傑,山東大學齊魯醫院張猛教授、張運院士和山東大學基礎醫學院高成江教授為該論文的共同通訊作者。山東大學齊魯醫院為第一和通訊作者單位。
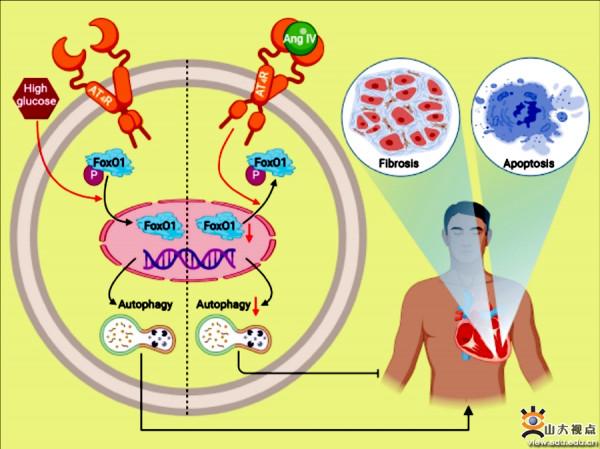
在世界範圍內,糖尿病的發病率持續上升,且具有明顯的年輕化趨勢。糖尿病患者的糖脂代謝異常可引起心肌細胞的進行性損傷並激活心肌成纖維細胞,導致心肌間質纖維化和心臟功能的進行性減退。以往研究發現,腎素-血管緊張素系統(RAAS)過度啟用和心肌細胞自噬異常可能是糖尿病導致心肌損傷和心室重構的重要機制,因此,尋找RAAS和心肌細胞自噬共同的調控因子或藥物可能為改善糖尿病心肌損傷和心室重構提供重要的干預靶點。課題組首先在C57BL/6J背景的小鼠中誘發糖尿病,分別給予小鼠低、中、高三種劑量的RAAS新成員血管緊張素IV(Ang IV)干預,結果顯示,未乾預糖尿病小鼠心功能明顯異常,而給予Ang IV干預可劑量依賴性地減輕糖尿病小鼠的心臟功能障礙。病理學研究顯示,未經干預的糖尿病小鼠表現明顯的心肌結構異常,經Ang IV尤其是高劑量Ang IV干預後,這些心肌形態和超微結構的異常在很大程度上得到了逆轉。此外,與正常小鼠相比,糖尿病小鼠心肌中有顯著的膠原沉積,I型和III型膠原蛋白以及TGF-β1的蛋白表達顯著上調,心肌凋亡標誌物表達明顯增加,而Ang IV干預可劑量依賴性地降低這些分子的異常表達。這些結果表明,Ang IV可劑量依賴性地減輕糖尿病小鼠的心功能障礙、間質纖維化和心肌細胞凋亡。差異表達基因分析顯示,糖尿病促進小鼠心肌自噬及FoxO1表達,該作用可被Ang IV劑量依賴性地抑制,而Ang IV受體AT4R拮抗劑Divalinal可完全拮抗Ang IV的心肌保護作用。與Ang IV相似,FoxO1 抑制劑AS1842856可延緩小鼠的糖尿病性心肌病的發生和發展。體外實驗證明,在高糖刺激下,FoxO1可能是Ang IV-AT4R軸的下游分子。該研究結果表明,糖尿病早期給予Ang IV干預可延緩心室重構和心功能減退,並改善自噬異常。Ang IV啟用AT4R後可阻斷FoxO1核轉位介導的心肌細胞自噬、凋亡和膠原分泌。因此,Ang IV-AT4R是心室重構和心力衰竭的潛在干預靶點,鑑於Ang IV是一個小分子多肽,因此該研究結果具有較好的轉化應用價值。
該研究發表於國際期刊《治療診斷學》(Theranostics,中科院一區,最新IF 11.556),論文的第一作者是山東大學齊魯醫院心內科章萌醫師,山東大學齊魯醫院心內科張運院士、張澄教授和郝盼盼教授為該論文的共同通訊作者。
文章連結:
1.Deficient Chaperone-Mediated Autophagy Promotes Inflammation and Atherosclerosis
2. The E3 ubiquitin ligase TRIM31 plays a critical role in hypertensive nephropathy by promoting proteasomal degradation of MAP3K7 in the TGF-β1 signaling pathway
3. Angiotensin IV attenuates diabetic cardiomyopathy via suppressing FoxO1-induced excessive autophagy, apoptosis and fibrosis