“科學的進步取決於新技術、新發現和新想法” | 圖源:pixabay.com
導 讀
一種叫做內源性大麻素的化學物質,對人的發育、睡眠週期、能量代謝、學習和記憶等諸多生理過程非常重要,但要在活體中檢測它一直很困難。
最近,專注於神經遞質探針研究的李毓龍團隊,開發出專門針對內源性大麻素的靈敏熒光探針,使得實時追蹤這一物質變得容易起來。
撰文 | 李可
責編 | 計永勝
● ● ●
人類大腦由八百億個神經元組成,後者又透過數萬億個突觸組成複雜的神經網路。在這個複雜網路中,神經元突觸末梢會釋放神經遞質(Neurotransmitter),如乙醯膽鹼、多巴胺等,作用於神經元或效應細胞膜上的受體,發揮資訊傳遞的功能。同時,神經元還會產生另一類化學物質,它們不直接傳遞資訊,而是透過間接調製神經遞質的量及活動水平,以增強或削弱資訊傳遞效應,這些化學物質被稱為神經調質(Neuromodulator)。
內源性大麻素就是其中重要一員,其廣泛分佈於周圍神經和中樞神經系統。與儲存在突觸囊泡並由突觸前末端釋放的經典神經遞質不同,內源性大麻素通常從突觸後膜產生並釋放,然後逆行到突觸前末端並激活大麻素受體,它的啟用通常會抑制一些神經遞質的釋放。
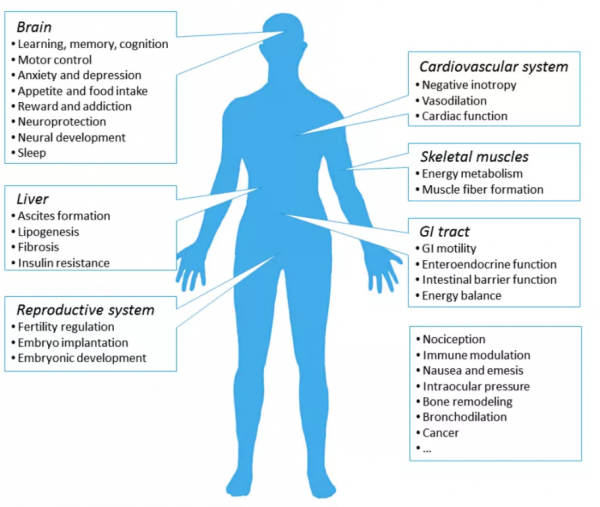
圖1 大麻素受體在人體組織器官的分佈 | 圖源:參考文獻[1]
內源性大麻素(Endocannabinoids,eCBs)主要有兩種脂質代謝物2-花生四烯醯甘油(2-AG)和花生四烯乙醇胺(AEA),其生物學功能主要由1型和2型大麻素受體(CB1R和CB2R)的啟用來介導。它在發育、情緒狀態、疼痛、睡眠週期、能量代謝、學習和記憶等諸多生理過程中都發揮著重要的作用。多項研究表明,內源性大麻素系統的失調與多種疾病有關,包括神經精神疾病、神經退行性疾病、癲癇和癌症等。鑑於內源性大麻素在體內分佈的廣泛性和生理功能的多樣性,對其深入探究已成為治療神經系統疾病一個潛力巨大的研究方向。
要更好地研究內源性大麻素在生理、病理過程中扮演的角色,研究人員需要實時監測其在活體內特定腦區的特異訊號變化,看清它的 “一舉一動”。然而,受限於傳統檢測方法的低分子特異性、低時空解析度及其可能帶來的組織損傷,研究人員一直以來都缺乏對內源性大麻素動態變化的精確記錄手段。應用新開發的靈敏、特異的內源性大麻素探針以光學成像方式探究內源性大麻素釋放及其調控將打破這個困擾研究人員多年的瓶頸。
2021年11月12日,《自然·生物技術》(Nature Biotechnology)雜誌線上發表了北京大學生命科學學院李毓龍團隊關於內源性大麻素特異性熒光探針的開發與應用的研究論文。這是該團隊在連續開發出重要神經遞質乙醯膽鹼探針、多巴胺探針、去甲腎上腺素探針、腺苷探針和五羥色胺探針之後 [3-7],運用對G蛋白偶聯受體的改造在神經遞質/調質檢測中的再次成功應用。
圖2 論文截圖
該類研究利用可與神經遞質/調質相結合的G蛋白偶聯受體作為探針的骨架,把對結構變化敏感的熒光蛋白(cpEGFP)嵌入受體。受體與神經遞質/調質結合引發構象變化便會被轉換為熒光訊號。研究者結合現代成像技術,就能看到神經遞質/調質濃度實時變化情況。在此基礎上,研究者針對不同的神經遞質/調質還對探針進行了全方位的最佳化,使具有極高的分子特異性和時空解析度。該團隊將這種高效的內源性大麻素探針命名為eCB2.0。
圖3 探針設計原理 | 圖源:參考文獻[2]
該論文開發的內源性大麻素特異性探針eCB2.0具有極高的靈敏度、特異性、信噪比、動力學和光穩定性,可以高時空解析度地精確檢測動物活體內內源性大麻素的動態變化。與以往探針一樣,該探針也具有可基因編碼的特性。研究者可以透過轉染、病毒注射以及構建轉基因動物等手段,將eCB2.0表達在HEK293T人胚胎腎細胞、神經元細胞、小鼠腦片,以及活體小鼠中。
圖4 eCB2.0可表達在體外培養的細胞膜上 | 圖源:參考文獻[2]
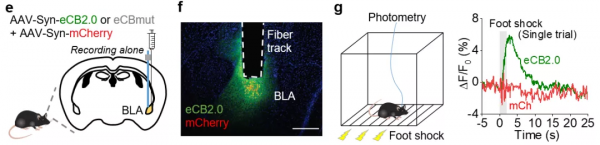
同時,該探針能夠分別特異性檢測到清醒小鼠腦杏仁核基底外側和海馬體中由足電擊刺激和奔跑觸發的內源性大麻素的動態變化。
圖5 eCB2.0可檢測自由運動的小鼠大腦杏仁核部位的內源性大麻素的動態變化 | 圖源:參考文獻[2]
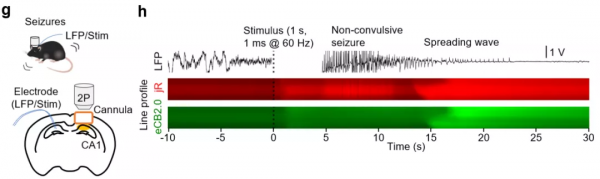
此外,在小鼠癲癇模型中,研究人員透過該探針檢測到了小鼠海馬體神經元興奮導致的內源性大麻素釋放。這些結論進一步證實了其在體內應用時強大的靈敏度、特異性、信噪比、動力學和光穩定性,並且清楚地展示了內源性大麻素探針如何幫助闡明生理和病理過程中的快速內源性大麻素動態。
圖6 新型探針檢測小鼠發生癲癇時海馬CA1區內源性大麻素的動態變化 | 圖源:參考文獻[2]
關於新型內源性大麻素探針的未來發展和應用,論文提到,鑑於神經系統的複雜性,該探針應用的未來研究方向可能包括內源性大麻素釋放的細胞型別的識別、內源性大麻素釋放的機制和時間特性、內源性大麻素擴散的特徵、內源性大麻素訊號的持續時間、內源性大麻素對亞細胞元素的影響等。
對這些基本問題的回答,將極大地豐富我們對內源性大麻素訊號在突觸和神經迴路水平的機制和功能的理解。因此,新型探針開啟了內源性大麻素研究的新時代,將提供研究者前所未有的、與生理相關的時空尺度來深入理解這一系統。
已逝諾獎得主、生物學家 Sydney Brenner 有一句著名的話:科學的進步取決於新技術、新發現和新想法。李毓龍常常在報告中引用這句話,他堅信技術的價值。
目前,斯坦福大學Ivan Soltesz實驗室已經藉助這一探針解析了活體動物海馬體內源大麻素訊號的分子特性和時空動態,發現與正常的生理活動相比,癲癇會引起大量2-AG的釋放,而2-AG為長時程的中風樣症狀提供了基礎底物。[8]
不久前,李毓龍在接受Neuron 雜誌專訪時表示,他的實驗室接下來將開發能夠檢測更多化學訊號的探針,也將致力於將這些新工具應用到神經系統的研究中,包括在生理及疾病環境下神經遞質釋放、回收的調控機制,以及他們所扮演的具體功能的研究 [9]。
神經生物學家、斯坦福大學生物系教授駱利群評論說,李毓龍在開發使用G蛋白偶聯受體感測器檢測神經遞質的探針方面已處於世界領先地位,“他開發的感測器已得到廣泛的應用。我相信這些新的感測器將使得新的生物發現成為可能。”
參考文獻:
[1] Zou, S., & Kumar, U. (2018). Cannabinoid receptors and the endocannabinoid system: signaling and function in the central nervous system. International journal of molecular sciences, 19(3), 833.
[2] Dong, A., He, K., Dudok, B., Farrell, J., Guan, W., & Li. Y. (2021) . A fluorescent sensor for spatiotemporally resolved imaging of endocannabinoid dynamics in vivo. Nature Biotechnology.
[3] Feng, J., Zhang, C., Lischinsky,J., Jing, M., Zhou, J., Wang, H., ... & Li, Y. (2019). A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron.
[4] Jing, M., Zhang, P., Wang, G., Feng, J., Mesik, L., Zeng, J., ... Zhu, JJ& Li, Y. (2018). A genetically-encoded fluorescent acetylcholine indicator for in vitro and in vivo studies. Nature Biotechnology.
[5] Sun, F., Zeng, J., Jing, M., Zhou, J., Feng, J., Owen, S., ... & Li, Y.(2018). A genetically-encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell.
[6] Peng, W., Wu, Z., Song, K., Zhang, S., Li, Y., & Xu, M. (2020). Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science, 369(6508).
[7] Wan, J., Peng, W., Li, X., Qian, T., Song, K., Zeng, J., ... & Li, Y. (2021). A genetically encoded sensor for measuring serotonin dynamics. Nature Neuroscience, 24(5), 746-752.
[8] Farrell, J. S., Colangeli, R., Dong, A., George, A. G., Addo-Osafo, K., Kingsley, P. J., ... & Soltesz, I. (2021). In vivo endocannabinoid dynamics at the timescale of physiological and pathological neural activity. Neuron, 109(15), 2398-2403.
[9] https://doi.org/10.1016/j.neuron.2021.10.013