本文來自微信公眾號:X-MOLNews
羰基化合物不僅廉價易得,且在自然界中廣泛存在,是一類非常重要的有機合成中間體。事實上,化合物中羰基的位置會顯著影響其生物活性和理化性質,例如:將熊果酸中C3-OH遷移到相鄰的C2位時會將糖原磷酸化酶的抑制效力提升13倍(圖1A);去甲託品酮C2-羰基衍生化合物改善氨基糖苷類引起聽力損傷的活性,要比相應的C3-羰基類似物高9倍。從合成的角度來講,有效的1,2-羰基遷移策略還可以簡化複雜分子(如:cascarillone 和lycoraminene)的合成步驟(圖1B)。目前,最常用的1,2-羰基遷移策略是利用酮的α-官能團化引入羰基替代物或者形成三元環、1,2-二酮中間體,然後再進行後續的一系列轉化(圖1C)。這些策略不僅步驟冗長,而且底物的官能團耐受性和區域選擇性很受侷限,迫切需要發展一種通用且高效的1,2-羰基遷移策略。
近日,美國芝加哥大學的董廣彬教授課題組發展了一種簡便的一鍋或兩鍋法,將羰基中的氧轉移到相鄰碳上,實現了羰基的1,2-遷移(圖1D)。具體而言,將酮化合物先轉化為相應的烯基三氟甲磺酸酯,接著透過鈀和降冰片烯(Pd/NBE)催化的區域選擇性α-胺化和ipso-氫化得到“轉位(transposed)烯胺”中間體,後者經水解便可得到所需的1,2-羰基遷移產物。相關成果發表在Science 上。
圖1. 1,2-羰基遷移策略。圖片來源:Science
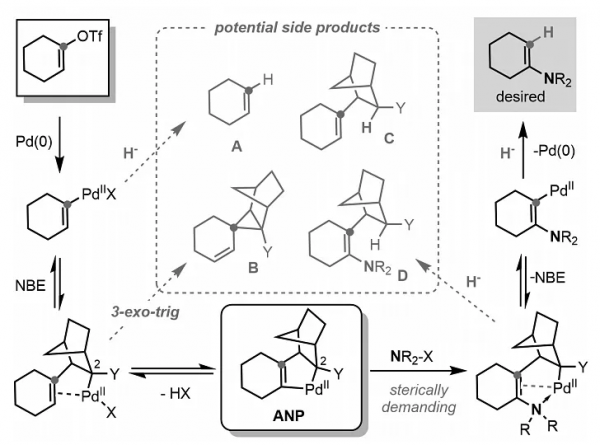
儘管Pd/NBE協同催化自1997年發現以來已廣泛應用於芳烴的官能團化,但是卻很少應用於非芳族底物的官能團化,特別是將雜原子取代基引入烯基底物中。如圖2所示,為了實現Pd/NBE協同催化的烯基三氟甲磺酸酯的α-胺化和ipso-氫化,必須要克服以下兩個挑戰:首先,烯基三氟甲磺酸酯與Pd(0)氧化加成後得到的烯基-Pd(II)物種與NBE進行遷移插入時,NBE助催化劑必須在C2位(與Pd鍵合的碳)帶有剛性取代基(如醯胺基團),以避免不期望的3-exo-trig環化副產物 B(已知的主要競爭途徑)。儘管NBE上增加的空間位阻可能不會阻礙其與體積較小的親電試劑(如伯烷基鹵化物)進行反應,但是當使用空間要求更高的胺親電試劑時可能會延緩反應,從而導致副產物A和C的生成。其次,即便確實發生了C-H鍵胺化,所得的烯胺部分也會透過氮孤對電子或富電子π鍵與Pd(II)物種強烈配位,這可能會使得NBE的解離(β-碳消除步驟)難以進行,導致副產物D的生成。
圖2. Pd/NBE催化烯基三氟甲磺酸酯α-胺化面臨的挑戰。圖片來源:Science
首先,作者選擇α-四氫萘酮(1)為模板底物、Tf2O為三氟甲磺酸酯化試劑、Cs2CO3為鹼、甲苯和1,4-二氧六環為混合溶劑於40 ℃下進行反應,以接近定量的收率得到烯基三氟甲磺酸酯2(圖3)。隨後,作者對Pd/NBE協同催化的烯基三氟甲磺酸酯的α-胺化和ipso-氫化條件進行了最佳化,最終以88%的收率一鍋法得到了所需的β-四氫萘酮產物(3)。另外,對照實驗表明鈀催化劑和NBE對該反應至關重要,並且在沒有吡啶酮新增劑的情況下產率大幅降低。
圖3. 反應條件最佳化。圖片來源:Science
在最優條件下,作者對該反應的底物範圍進行了考察(圖4),結果顯示不同基團取代的α-四氫萘酮衍生物(5、6、8-14)、二氫苯並噻喃酮(7)、1-茚酮(15)、1-苯並環庚酮(16)甚至苯並環庚烯酮(17)均能實現一鍋法轉化,以中等至良好的收率得到所需的1,2-羰基遷移產物,其中底物7和13將烯基三氟甲磺酸酯中間體純化後的總收率更高。此外,非共軛酮(18-33)也能相容該反應,只不過兩步法合成(使用LiTMP為鹼)的收率更高,儘管一鍋法也能提供所需產物(如18)。值得一提的是,該反應能夠耐受多種官能團,例如:芳基氯(11)、氰基(10)、硝基(13)、苄醚(20)、磺醯胺(21)、烯基(22、30、34)、縮醛(31)、酯基(12、28)、內酯(34、38)、噻吩(8、14)、喹唑啉(23、24)、茶鹼(25)和吲哚(26)等。有意義的是,天然產物(如託品酮(35)、諾蒎酮(36)、豬脫氧膽酸(37)和α-山道年(38))衍生的烯基三氟甲磺酸酯也能順利地進行1,2-羰基遷移,以良好的收率提供相應的羰基遷移類似物。
圖4. 底物範圍。圖片來源:Science
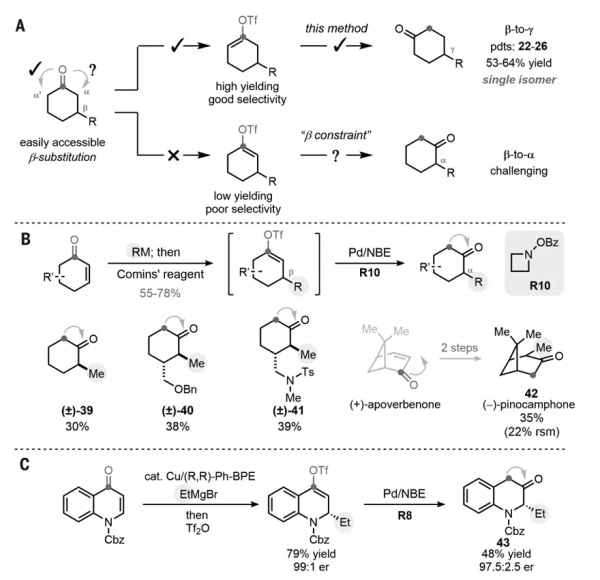
如圖5A所示,將β-取代的環己酮轉化為γ-取代的環己酮很容易進行(如:22-26);但是向另一方向的羰基遷移(β→α)卻較為困難,這是因為相應的烯醇化物(動力學不利)通常以低收率和低選擇性形成。此外,在所需的烯基三氟甲磺酸酯中存在β-取代基會阻礙C-H鍵鈀化,因此要想實現這種“β-to-α”轉化可謂是難上加難。為此,作者嘗試發展一種基於烯酮的替代策略(圖5B)。具體而言,烷基親核試劑與環己烯酮底物進行共軛加成,然後用Cominsˊ試劑淬滅,以中等至良好的收率得到所需的烯基三氟甲磺酸酯。考慮到β-空間位阻,作者認為體積較小的胺親電試劑應該有利於C-H鍵胺化步驟。實際上,氮雜環丁烷衍生的親電試劑(R10)效果最好,以中等的收率得到所需的β-to-α遷移產物(40和41)且相對立體化學完全保留,而先前的方法則是無法合成的。此外,從(+)-二甲基雙環庚烯酮出發,經兩步轉化便可得到(-)-松樟酮(42)。鑑於酮的直接不對稱非烯丙基α-烷基化極具挑戰性,因此該策略對於手性純α-烷基化酮的製備十分有用。例如,透過對映選擇性共軛烷基加成和1,2-羰基遷移策略便可以優異的對映選擇性獲得α-乙基酮 43(圖5C)。
圖5. 透過共軛加成來實現β-取代。圖片來源:Science
最後,作者探討了該方法的合成應用(圖6)。當Danishefsky’s二烯與Michael受體進行反應時,得到了C4位帶有吸電子基團的環己酮(圖6A);而利用本文的方法則可以良好的收率獲得逆區域選擇性Diels-Alder產物(即吸電子基團位於C3位)。除質子外,其它親電試劑(如:烯丙基溴)也可以捕獲烯胺中間體生成產物46(圖6B)。有趣的是,不對稱共軛加成和1,2-羰基遷移還能以對映選擇性方式引入γ-立體中心。具體而言,從烯酮出發,經不對稱共軛加成和1,2-羰基遷移得到手性純的酮48,後者經非對映選擇性還原得到醇中間體(49),隨後進一步轉化為食慾素受體拮抗劑(50),而先前的方法則是透過手性拆分製備的(圖6C)。此外,從類固醇二氫睪酮醋酸酯和二氫膽甾酮出發,經兩步轉化便可得到生物活性的“C2-oxo”類似物;而先前則需要五步合成且總收率分別為<39%和10%(圖6D)。最後,作者從簡單易得的香葉基溴出發,僅需三步便可以32%的總收率合成trans-萘烷酮中間體54(pallescensin A全合成的關鍵中間體),而先前的方法則從Wieland-Miescher酮出發,需要八步才能合成,總產率僅21%(圖6E)。
圖6. 反應的合成應用。圖片來源:Science
總結
董廣彬教授課題組在鈀/降冰片烯(Pd/NBE)的協同催化作用下,發展了一種簡便實用的1,2-羰基遷移策略。該反應不僅底物範圍廣、官能團耐受性好,而且透過合理的試劑選擇,可以控制羰基遷移的方向,從而生成γ-取代產物或更具挑戰性的α-取代產物。毫無疑問,該策略非常適合藥物最佳化過程中複雜分子的後期修飾與變化,有望成為天然產物及藥物化學領域中的強大工具。
Carbonyl 1,2-transposition through triflate-mediated α-amination
Zhao Wu, Xiaolong Xu, Jianchun Wang, Guangbin Dong
Science, 2021, 374, 734–740, DOI: 10.1126/science.abl7854
導師介紹
董廣彬
https://www.x-mol.com/university/faculty/352