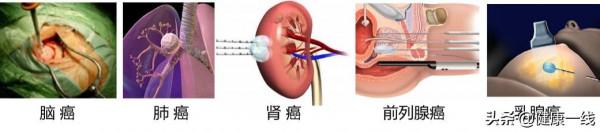
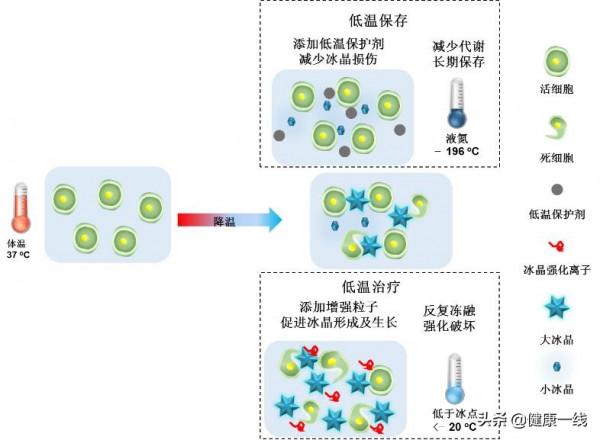
低溫生物醫學是研究低溫與生物體相互作用規律及其醫學應用的學科。目前,低溫生物醫學應用主要涉及低溫儲存及低溫治療兩方面(圖1)。其中,
低溫儲存是指將生物材料(如細胞、組織、器官)在新增低溫保護劑的情況下冷卻至低溫(一般為-196 ℃液氮儲存),待需要時再將其以有效的方式復溫至正常溫度(37 ℃),此時生物樣品仍可恢復並保持其活性。
低溫治療則是以微創介入的方式將探針插入腫瘤組織,手術開始後啟動低溫探針,透過探針內部冷介質在探針頭部與腫瘤組織的冷量交換,使腫瘤組織處於低溫環境,冰球完全覆蓋腫瘤靶病灶組織(≤-20 ℃)並維持一段低溫治療時間,以達到殺死腫瘤細胞的目的,手術結束後取出探針,腫瘤原位消解。
圖1 低溫儲存及低溫治療示意圖
1. 凝固時光的技術——低溫儲存
在低溫下,生物體新陳代謝的速率大大降低(圖2),進入“生理機制暫停”的狀態,同時有效躲避了外界干擾,為“無限期”儲存創造了條件,因此低溫儲存能使生物材料得以長期安全儲存。一般來說,樣品儲存的溫度越低,儲存的時間就越長,在4 ℃時存活時間只有數小時的生物樣本,在-80 ℃下可以儲存數月,在-196 ℃下,隨著反應速率近乎於0,能儲存數世紀。目前,低溫儲存技術是生物材料長期儲存的唯一可行途徑。
圖2 生物樣品低溫儲存的時間與溫度之間的關係
在植物種子質量(即種質)的長期儲存上,低溫儲存提供了必不可少的技術支撐,具有省事、省工、省費用的特點,尤其適合長期儲存珍貴稀有種質。一位俄羅斯科學家利用三萬年前冰凍在西伯利亞科雷馬河永凍層裡的種子,成功培育出一棵植物,打破復甦最古老植物種子的記錄(圖3),事實上正是低溫環境使得該物種的遺傳物質得以完整的儲存,幫助這枚種子安全度過三萬年的休眠期。在挪威斯瓦爾巴特群島上,有一個全球最大的植物末日種子庫(圖4),以防因全球物種迅速縮減而造成物種滅絕,被稱為“世界末日”地球資源的諾亞方舟。
圖3 俄羅斯科學家復甦三萬年前的種子
圖4 挪威植物末日種子庫
在新興的醫學前沿領域,利用現代低溫儲存技術,人類精子、卵子及胚胎長期儲存已成為現實(圖5)。1983年,世界首例“冷凍寶寶”出生,人類胚胎冷凍儲存技術逐漸發展成熟,低溫冷凍儲存技術逐漸成為輔助生殖技術中不可或缺的重要技術之一。2017年年末,美國冷凍了24年的胚胎寶寶出生,打破了儲存最久冷凍胚胎成功生產的世界紀錄。現代胚胎儲存是將胚胎和低溫保護液裝入專用的冷凍管中,透過慢速(對於第2-3天的胚胎)或者快速(玻璃化儲存,對於第5-6天的囊胚)的方法使胚胎浸入-196℃的液氮中,減少代謝從而得以儲存。目前,穩定的高復活率的胚胎冷凍技術仍然是研究人員追求的目標,這將為不孕不育患者儲存生育能力、延續生命提供了基礎技術支援。
圖5 低溫儲存輔助生殖技術
除此之外,各類生物樣本庫(如生殖樣本庫、疾病樣本庫、中華民族生物樣本庫及幹細胞庫)的建設,為儲存各種人類資源都起到了重大作用。特別是,對於器官移植,臨床上目前多采用短期低溫儲存或延時儲存技術(4℃左右),但器官的冷缺血耐受時間(不損害器官結構功能的前提下,從放置在低溫環境到正常恢復血供的時間)較短,心肺為4小時,肝、腸、胰腺為8~12小時,腎最長為36小時,但其功能細胞-腎小球耐受時間只有不到24小時。這導致了目前臨床上超過70%的心臟因為評估和匹配的所需時間超過了儲存限制而被廢棄。以我國腎器官移植現狀為例,每年需要進行移植的人約有30萬,但實際只有2000多人能及時獲得介面卡官接受手術。因此面對器官庫短缺以及可用率低的問題,最有效的解決方案就是尋求器官長期有效的低溫儲存方法,目前這一方向仍是全球挑戰性的重大難題。
在抗擊新冠病毒的醫療領域,低溫儲存技術也發揮了重要的作用。由於不同疫苗有著不同的儲運條件,這給冷鏈儲存帶來巨大挑戰,其中抗擊新冠疫情的mRNA 疫苗,對低溫儲運的要求極為嚴格(圖6),需要動態的深低溫儲運環境。針對不同的疫苗儲運,目前已制定了標準的儲存流程,為新冠疫苗的冷鏈輸運提供堅實的技術支援。
圖6新冠病毒疫苗低溫儲存引數
低溫儲存技術歷經數十年的發展,在實驗方法上取得了巨大成功,特別是近幾十年來,利用低溫儲存技術,已成功地實現了對絕大多數種類細胞的儲存,在面板、角膜等簡單組織的低溫儲存上也取得了一定進展,並在組織再生及器官移植中得到廣泛應用,極大地推動了臨床醫學的發展。器官甚至是活體的儲存挑戰仍在推動著這一領域的向前發展。
2. 腫瘤綠色治療方法——低溫治療
早在古埃及時代,人們就透過冷敷來減輕炎症,低溫的治療作用已被意識到。近世紀以來,戰場上,醫護人員利用低溫減輕肢體手術的疼痛。而近年來,低溫對於減緩癌症發展、治療腫瘤的作用也逐漸被人們認識。
低溫治療腫瘤(圖7),通常是以一種微創的方式將冷凍探針直接插入到腫瘤部位,並利用製冷技術在探針針頭實現可控的降溫和升溫功能。在冷凍過程中,探針周圍會形成冰球,使腫瘤組織溫度低至-20 ℃以下,並維持一段時間,透過探針持續不斷地冷凍、解凍病灶,產生一系列不可逆損傷,達到消除病灶的目的。與其他治療方式相比,低溫手術由於具有影像可視、麻醉鎮痛、止血或減少出血、手術創口小以及能防止腫瘤擴散等優點,並且其副作用遠低於放療和化療,因而在腫瘤治療方面贏得了“綠色療法”之譽。低溫外科手術已拓展應用到幾乎所有的實體腫瘤治療,被學術界和醫學界公認為是一種治療腫瘤的重要方法。
圖7 低溫治療腫瘤
低溫治療癌症效果明顯,複發率低。早在1961年,美國醫生I. S. Cooper就首次運用液氮冷刀,取得了良好的醫療效果。2002年,日本慶應大學醫學院利用低溫治療42例晚期肝癌患者,腫瘤的完全消融率達到了92.2%。2017年,美國研究人員在學術期刊JVIR上發表了一組關於低溫治療腎癌的臨床資料,共302名腎癌患者接受了低溫治療手術,32個月後,腫瘤的複發率僅為3.2%。
低溫治療癌症蓬勃發展,對於癌症患者來說,不僅僅是治療上有了新的更加低痛苦的選擇,更是帶來了生的希望。臨床上,對各種型別的早中晚期惡性實體瘤(比如肝癌、肺癌、乳腺癌等)患者,均可採取低溫治療方式。特別是對於那些失去了常規手術治療機會的晚期患者、轉移患者、年齡大或身體虛弱患者、不願意進行常規手術的患者,低溫治療癌症為他們提供了生的希望。
隨著低溫外科手術(也被稱為冷凍治療)在惡性腫瘤治療中令人鼓舞的大量成功應用,腫瘤微創冷凍治療逐漸成為微創醫學特別是低溫生物醫學技術在現代臨床實踐中發揮重大關鍵性作用的一個典範(圖8)。以中國為例,經過短短十餘年的快速發展,目前全國已有超過100家醫院(如中國人民解放軍總醫院、中國醫學科學院腫瘤醫院、北京腫瘤醫院、復旦腫瘤醫院等)開展腫瘤冷凍治療業務,並呈快速增長趨勢;而在美國,開展冷凍治療的醫院已超過450家(如MD Anderson Cancer Center, Mayo Clinic, Mountain Sinai Hospital等)。最近幾年,全球多個區域還紛紛成立冷凍治療學會,旨在推進這一新型高效腫瘤療法的研究和應用。不難看出,國內外醫學界對腫瘤冷凍治療技術具有廣泛而迫切的重大需求。
圖8一體式低溫冷凍腫瘤微創治療系統用於臨床治療腫瘤
3. 低溫雙刃劍:默默無聞的保護 or 所向披靡的破壞?
低溫儲存與低溫治療都是透過低溫來實現,那麼兩者之間有什麼差異呢?究竟兩者如何區分呢,又如何確保各自的效果呢?
低溫儲存與低溫治療具有類似的操作流程:實施降溫使生物樣本處於低溫環境,再透過復溫使生物樣本處於常溫環境中。
但是低溫儲存與低溫治療也有本質的不同:
新增物不同:對於絕大部分哺乳動物有核細胞的低溫儲存來說,無論是慢速冷凍儲存還是玻璃化凍存都需要新增一定濃度的冷凍保護劑來避免低溫損傷;而低溫治療則不需要新增保護劑,甚至有時會新增強化破壞作用和細胞損傷的冷凍增敏劑。在同樣的升降溫條件下,是否新增低溫保護劑決定了大多數生物樣品在低溫下產生的是保護作用還是破壞作用。
降溫/升溫引數不同:不同的降溫及升溫速率導致的細胞破壞力不同(見圖9)。在低溫儲存過程中,對於大部分哺乳類細胞,經常採用的是慢速低溫儲存方法,慢速冷凍儲存的降溫速率需要進行最佳化,合適的降溫速率有助於維持冰晶損傷與溶液損傷之間的平衡(如圖9所示),對於一般的哺乳類細胞,降溫速率經常採用1 ℃/min;而在升溫過程中,需要比較快的升溫速率,且復溫溫度不應達到細胞熱損傷溫度,樣品從-196 ℃液氮中取出放到37 ℃水浴中快速復溫,這個過程一般控制在1~2 min。在低溫治療過程中,探針附近的組織降溫速率較快,一般是47~116 ℃/min;距離探針中心約1 cm處,冷卻速率降為10~20 ℃/min;所以透過對探針插入位置的調整,可以在對腫瘤進行適形化冷凍殺傷的同時,避免對周圍非腫瘤組織的冷凍損傷。升溫速率也非常快,從-196 ℃到80 ℃加熱迴圈開始,一般是控制在2 min之內,迅速在深低溫及高溫之間切換組織產生的熱應力所造成的機械損傷對腫瘤細胞產生了致命的破壞。值得指出的是,當降溫速率足夠快時(比如,純水的臨界降溫速率為3×108 ℃/min),可以實現低溫玻璃化儲存(如圖9a),但冷凍治療裝置一般都達不到這個速度,所以低溫治療裝置只能起到低溫破壞作用。
除了升降溫速率不同,低溫儲存和低溫治療的凍融迴圈次數也不同。低溫儲存是為了讓生物樣本在低溫下維持低代謝甚至是零代謝狀態,從而保持生命週期,所以生物樣本在低溫儲存中只會經歷一次凍融迴圈。而低溫治療,會根據要求對腫瘤組織進行一次或多次凍融,以加強對腫瘤組織的破壞性。Whittaker對倉鼠口腔粘膜進行了反覆凍融,發現細胞內冰晶會在每次凍融迴圈的間隔中增加。所有,目前為了破壞腫瘤組織,需要快速冷凍組織,並進行反覆凍融。
圖9 不同降溫及升溫速率下的細胞損傷曲線。
低溫作用物件尺度不同:低溫儲存目前可以實現血細胞、懸浮細胞液、卵母細胞等細胞尺度樣品的成功凍存,對於 1 mm以下的單一功能生物樣本如面板、角膜等也可以實現較高的存活率,但是,目前最為先進的低溫儲存技術對於1 mm以上的複雜生物樣本(包括血管與多種異質細胞)仍存在嚴峻挑戰。而對於低溫治療的腫瘤組織,直徑一般都在5 mm以上。隨著生物樣本體積增大,傳熱速度不均勻性增大,以及冰晶形成釋放大量潛熱,大尺度生物樣本的均溫一直是個難題。溫度的不均勻性及組織各向異性等引起熱收縮不均勻,會造成嚴重的熱應力。當熱機械應力超過生物組織極限時,會造成生物樣本的永久性損傷,這對於生物樣本在低溫下的存活是極其不利的。
控冰作用不同:在低溫儲存過程中,需要藉助材料和技術的手段,減少相變過程中冰核的形成、抑制冰晶的生長和重結晶的出現;而在低溫治療過程中,反而需要強化破壞作用,冰核的形成、冰晶的快速生長及重結晶則有助於破壞腫瘤(圖10)。
圖10 低溫儲存與低溫治療差異性
由於生物樣本中大部分成分為水(超過70%),所以控制冰晶的形成及生長對於低溫儲存功至關重要,透過選擇合適的低溫儲存保護劑及低溫治療增敏劑可以實現冰晶的生長調控,那麼,一般情況下應該如何選擇呢?
透過新增抑冰材料(低溫保護劑)來調節冰晶成核和控制冰生長和形狀是十分可行的途徑(圖11)。1949 年,英國生物學家 C. Polge 和 A. U. Smith 偶然發現甘油可以幫助精子經歷低溫冷凍而不死亡,使低溫保護劑作為低溫儲存的一個重要研究方向登上歷史舞臺。低溫保護劑可以幫助保護生物樣本免受低溫損傷,在細胞凍存中常被配製成一定濃度的溶液,其可以透過減少冰形成量來減少細胞脫水。低溫保護劑在降低冰晶形成速率方面表現突出。低溫保護劑如多元醇和糖,特別是海藻糖和蔗糖,甚至可以替代與其結構相關的水,並防止變性或相變,以保護膜和蛋白質免於冷凍期間的乾燥應激。在冷凍儲存方案的設計中,選擇合適的冷凍保護劑組合,最佳化低溫保護劑的濃度對於生物樣本低溫儲存效果的影響非常大。
圖11 低溫儲存劑對於抑制冰晶形成、生長、及修飾冰晶形貌的作用
在體環境下水溶液成核及冰晶生長可透過新增功能顆粒來增強。相關研究結果表明,高熱導率功能顆粒的載入所產生的冷凍效果提升十分顯著(圖12)。而且,注射不同的功能顆粒懸液會產生不同的冷凍增強效果,該特性用於低溫手術中可對目標組織的冷凍效果實施調控。此外,靶向冰晶成核劑的引入還會在降溫過程中強化腫瘤細胞特定位點的冰晶成核。
圖12導熱增強功能材料促進冷凍過程冰晶形成
對於冰晶生長的精準調控是減少細胞冷凍儲存損傷或強化細胞冷凍殺傷的基礎(圖13)。簡單來說,無論是低溫儲存和低溫治療都需要精準控制細胞內外結冰的時空分佈。
圖13 冰晶生長的精準調控實現低溫儲存及低溫治療
4. 未來:低溫儲存——無冰共生,低溫治療——遇冰皆消
在低溫儲存領域,目前對於一些簡單的細胞,已經能夠實現比較理想的凍存復活率,但是對於複雜的多細胞生物體系,如大尺度組織、器官,甚至是複雜的生命活體的低溫儲存仍有待於破解,低溫對於大尺度生物樣本生命週期的拓展深深吸引著研究人員的注意。
在低溫治療領域,如何確保複雜生理環境下腫瘤的適形化消融以達到最最佳化治療效果,仍遠未達到理想的程度,甚至因諸多活體因素制約,情況更為複雜。精準化適形化的低溫治療技術是未來的主要發展方向。
低溫生物醫學工程學北京市重點實驗室,中國科學院理化技術研究所
竇蒙家, 李曉瑩,饒偉*