對於創新藥研發的風險和難度,大家在阿爾茨海默病這種疾病上已經有了比較深的體會。 禮來、羅氏、強生、默沙東、Biogen等一眾巨頭在這個適應症上折戟,眾多大型III期研究遭遇失敗,讓上百億美元的研發資金付諸東流。 儘管Biogen開發的Aducanumab在今年6月好不容易迎來上市,卻引來產業界一片爭議反對,並未得到市場認可。
其實,阿爾茨海默病只是人類面臨的眾多臨床需求未滿足的疾病之一。 在攻克各種複雜難治疾病的道路上,學術界和產業介面臨的艱難阻遏遠不止阿爾茨海默病一個,還有許多更難的空白地帶需要突破。 醫藥魔方按III期臨床試驗的成功率進行了統計,阿爾茨海默病新藥的III期成功率為25.8%,但這並不是最低的,排在最前面的膿毒症的新藥III期試驗成功率不足20%,堪稱全球新藥開發最難的適應症。
提起膿毒症,大家或許稍顯陌生,因為這是一種需要在醫院救治的危重症,死亡率極高,相比阿爾茨海默病這種在身邊日常發生的慢性病,感受就不會那麼強烈。 但實際上,膿毒症距離我們並不遙遠。 近期,新冠疫情在中國又出現反彈,零星散發案例頻現。 作為罪魁禍首的Delta毒株傳染性和毒力更強,也引起常態化疫情防控下許久不見的重症、危重症患者再次出現,讓大家的神經再次緊繃。
因為COVID-19而入住ICU的重症、危重症患者,會有較高風險進展為病毒性膿毒症,從而導致嚴重COVID-19患者的救治更加複雜。 已有資料統計顯示,膿毒症(Sepsis)是COVID-19全球流行所造成死亡的原因之一[1-2]。 今天,我們就在這裡為大家介紹這一下膿毒症,期望大家對這個“重症殺手”有進一步的瞭解,對這個領域的新藥研發也投入更多的關注。
膿毒症的定義和流行病學
膿毒症是感染、嚴重創傷、休克等重症患者的一種常見併發症,主要是由病原體(包括細菌、真菌、病毒及寄生蟲等)相關分子直接啟用免疫細胞和內皮細胞後大量釋放影響包括中樞神經、呼吸系統、代謝系統等在內的機體各個系統的炎症介質[3]。 機體對免疫反應失調,引起危及生命的器官功能障礙,導致多器官衰竭和死亡。
膿毒症病理生理學彙總(來源: 參考文獻[3])
膿毒症的概念最早出現於1991年,起初是建立在全身炎症反應綜合徵概念的基礎上[4],2016年以前被認為是感染引起的全身炎症反應綜合徵(Sepsis 1.0),出現器官功能障礙時定義為嚴重膿毒症; 2016年,膿毒症被重新定義為機體對感染產生的炎症反應失調而引起生理學和器官功能損害的臨床綜合徵(Sepsis 3.0)。 按膿毒症嚴重程度可分膿毒症、嚴重膿毒症(severesepsis)和膿毒性休克(septic shock)。
根據流行病學和資料 [5-6],2017年全球估計有4890萬例膿毒症病例和1100萬例膿毒症死亡病例,約佔全球所有死亡人數的20%。 2020年發表的基於51項研究的薈萃分析,每年成人膿毒症合併發病率為189/10萬人,死亡率為26.7%。
我國膿毒症發病率研究絕大多數是來自ICU住院患者,2020年一項針對全國44所醫院ICU的研究報告顯示,ICU膿毒症的發病率為20.6%。 死亡率方面,一項基於人口的膿毒症流行病學調查發現,2015年全國有1 025 997人死於膿毒症,佔總病死率的12.6%; 2006~2016年的一項759例嚴重膿毒症患者單中心回顧性研究資料顯示,我國膿毒症的病死亡率高達36%[7]。
參考文獻[6]
當然,不同地區的膿毒症發病率和死亡率存在差異。 儘管如此,膿毒症仍然是一個重要的醫療保健問題,具有高死亡率和發病率,並對資源利用和治療負擔產生重大影響。 通常,膿毒症的治療預後也不樂觀。 根據WHO報告[6],膿毒症出院患者中,僅一半患者能夠完全康復,40%的膿毒症患者在出院後90天內會二次住院,1/3在一年內死亡。 此外,一部分倖存者也會出現疾病相關後症狀,包括疲勞、神經肌肉無力、慢性疼痛、創傷後應激障礙、認知障礙、功能障礙和抑鬱症等,不僅增加了個人的膿毒症治療負擔,也增加了醫療保健系統和社會的負擔。
參考文獻[6]
膿毒症治療: 臨床用藥的空白地帶,
市場需求巨大
自2002年 “拯救膿毒症運動” 啟動以來,膿毒症的基礎研究與臨床研究均取得了一定進展,但膿毒症的發病率和致死率卻未顯著降低。 之所以出現這種情況,可能與膿毒症患者發生免疫紊亂有關。 免疫功能紊亂是膿毒症發生、發展的關鍵,從機制上看主要是以粒細胞為主的固有免疫處於過度活化狀態,而以淋巴細胞為主的獲得性免疫處於抑制狀態。 免疫紊亂也是膿毒症患者預後不良的一個關鍵原因[8]。
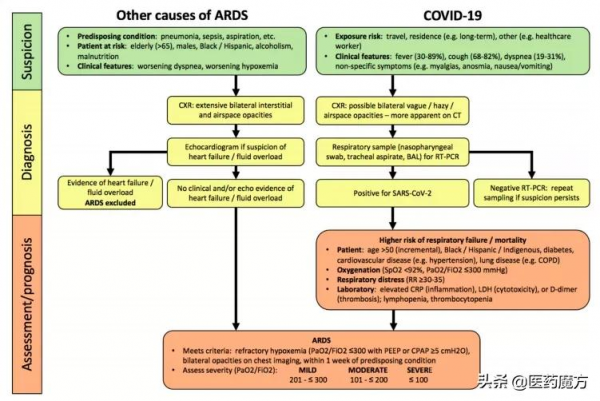
在膿毒症患者的諸多易受損器官中,肺臟是最易被攻擊的靶器官之一,患者常較早併發急性呼吸窘迫綜合徵(acute respiratory distress syndrome,ARDS),這也是膿毒症患者死亡的主要原因之一[9],因此膿毒症和ARDS在臨床治療上並不是完全割裂的疾病。 ARDS同時也是COVID-19患者中較常見的併發症,這是因為SARS-CoV-2、SARS-CoV以及Novel coronavirus 2012等病毒進入機體被免疫系統識別,從而引發旨在清除病原體的炎症反應,導致免疫細胞因子和免疫細胞之間的正反饋機制過度啟用,會產生大量細胞因子,從而引起ARDS。
不同原因導致的ARDS風險差異評估(來源: 文獻[10])
儘管對ARDS的發病機制有相對清晰的認識,然而,ARDS涉及多種促炎細胞因子、炎症受體和趨化因子的啟用,全球尚未批准公認有效的ARDS治療藥物。 因此,針對ARDS,呼吸支援技術是最主要的治療方式[11],同時要採取積極的清除病原體和對症支援。
因此,有創機械通氣(插管)、呼吸機、體外膜式氧合等也就成了初期應對COVID-19肺炎時頻繁報道的緊急操作和緊缺醫療裝置。 託珠單抗、地塞米松(重症患者)等少數藥物的超標籤使用成為治療ARDS的主要手段。
除了ARDS,膿毒症在臨床上還可能表現出其他的器官功能障礙,如凝血功能、肝腎功能和/或中樞神經功能障礙等。 整體來說,無論是膿毒症,還是ARDS,亦或是COVID-19肺炎,都迫切需要更多有效的治療藥物。 膿毒症和ARDS均是ICU常見危重症,病死率高,救治負擔重,尤其是膿毒症合併ARDS的患者治療挑戰巨大[12],能夠同時對這兩種疾病顯示治療功效的藥物全球範圍內都是空白。
不過,也正是基於如此迫切的未滿足臨床需求,膿毒症相關藥物也存在巨大的市場空間。 據報道,美國每年膿毒症治療費用超過200億美元,中國人均治療費用超過1萬美元。 如果有企業在此研發方向進行佈局並獲得成功,無論是社會價值還是潛在的商業回報無疑也都是巨大的。 尤其是在新冠病毒Delta變異毒株全球肆虐的背景之下,全球都在投入資源積極尋找防治COVID-19的藥物,如果有企業能夠能夠成功上市克服COVID-19繼發膿毒症的藥物,那對全球公共衛生體系的重建都是巨大貢獻。
膿毒症藥物現況
針對膿毒症,近幾十年鮮有創新藥物上市,重組活化蛋白 C(屈曲可淨α)是FDA在2002年批准上市的唯一一款用於膿毒症的藥物,卻因上市後確證試驗失敗而撤回。 當前,臨床用於膿毒症治療主要是根據Sepsis-3指南,採取早期液體復甦、抗感染藥物使用、神經肌肉阻滯劑以及器官支援等。 但是,在嚴格依照標準方案治療後,膿毒症患者的病死率仍未顯著降低,存在高度的未滿足臨床需求。
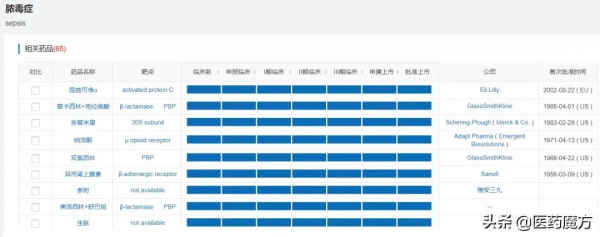
膿毒症的創新藥開發成功率極低,極少有企業將膿毒症作為業務優先佈局的方向。 根據醫藥魔方NextPharma資料庫,全球開發膿毒症這個適應症的新藥專案有65個,但是有43%是處於I期之前的階段,有25%是處於II-III期階段。 中國企業當中,開發膿毒症藥物的也屈指可數,包括遠大醫藥、亞寶藥業、紅日藥業、思路迪。 無論如何,我們首先應該為有勇氣挑戰這種全球最難開發適應症的企業喝彩。
在研膿毒症藥物的靶點和作用機制比較多樣,篇幅所限,僅以遠大醫藥為例介紹,因為其開發的膿毒症新藥STC3141也是比較有特色的一個。 與既往膿毒症藥物的開發思路都針對於炎症反應中的淋巴細胞不同,STC3141選擇了與其相對的方向,針對的是炎症反應中的粒細胞。 2020年,STC3141的臨床前研究資料發表在權威頂級期刊Nature Communications [13]。 從機制上看,STC3141透過中和胞外組蛋白和中性粒細胞誘捕網來逆轉機體過度免疫反應造成的器官損傷,從而達到治療效果。
遠大醫藥擁有STC3141全球權益,目前正在全球範圍內推進該專案的臨床開發。 其中,在澳大利亞開展的膿毒症的Ib期臨床和COVID-19引發的ARDS的 II期臨床,以及在比利時開展的COVID-19的II期臨床都已全面鋪開; 在中國針對ARDS的Ib期研究近期也完成了首例患者給藥。
除STC3141之外,遠大醫藥還有一款針對膿毒症的臨床前的藥物APAD。 APAD是遠大醫藥2020年3月與重慶安體新生物技術有限公司達成授權協議,獲得這款全球首創用於治療膿毒症的新藥技術及相關智慧財產權。 據遠大醫藥對外透露,APAD的作用機理是拮抗病原體相關分子,從膿毒症發病機制看來,遠大醫藥的這兩款創新藥能夠形成很好的協同作用來共同抗擊膿毒症等重症。 隨著多項臨床研究的開展,我們也期待著這幾款產品有好的表現,能夠成功上市,攻克這個最難開發適應症的壁壘,成為重症領域的重磅產品。
結語
ARDS和膿毒症均表現出個體差異的異質性,仍缺少高效、特性的治療藥物。 針對性的開發綜合個性化方法,更好地設計臨床試驗以分層或識別潛在受益的患者人群,或可減少異質性並提高治療的成功率以及患者的生存率。
同時,新技術和創新型別藥物在膿毒症領域的應用仍有待加強,包括開發和發現預測疾病發展和演變的先進技術與生物標記物,以及加速推進抗體藥物、免疫治療劑、細胞治療和mRNA產品等先進療法藥物在這一領域的佈局和研究。 在此也期待膿毒症的新藥研發能夠在不就的將來迎來突破。
參考資料
[1]膿毒症網站: https://www.global-sepsis-alliance.org/
[2]COVID-19 as cause ofviral sepsis: A Systematic Review and Meta-Analysis. medRxiv preprint doi: https://doi.org/10.1101/2020.12.02.20242354
[3]Jean-Marc Cavaillon,et al. Sepsistherapies: learning from 30 years of failure of translational research topropose new leads. Molecular Medicine 12: e10128 ; ChristopheLelubre, et al. Mechanisms and treatment of organ failure in sepsis. Nat RevNephrol. 2018 Jul;14(7):417-42
[4]夏文芳等,膿毒症的治療進展. 醫學綜述, 2019, vol 25(11):2169-2175
[5]Kristina E Rudd, etal. Global, regional, and national sepsis incidence and mortality, 1990–2017:analysis for the Global Burden of Disease Study. Lancet 2020,395: 200–11
[6]GLOBAL REPORT: ON THEEPIDEMIOLOGY AND BURDEN OF SEPSIS, World Health Organization 2020
[7]中國膿毒症早期預防與阻斷急診專家共識: 中國急救醫學,2020年,Vol40(7):577
[8]陳建平等.膿毒症免疫抑制機制及免疫調理治療新進展.醫學綜述. https://kns.cnki.net/kcms/detail/11.3553.R.20210604.1026.002.html
[9]唐甜. 炎症反應在膿毒症ARDS發病機制中的作用. 重慶醫學,2017,vol46(15): 2146-2149
[10]Shayan Kassirian,et al. Diagnosisand Management of Acute Respiratory Distress Syndrome in a Time of COVID-19. Diagnostics2020, 10, 1053
[11]李茂新等. 急性呼吸窘迫綜合徵的診療研究進展. 疑難病雜誌, 2021, vol20(3):304-309
[12]劉斌等.PiCCO在膿毒症合併急性呼吸窘迫綜合徵的應用的研究進展.重慶醫學.https://kns.cnki.net/kcms/detail/50.1097.R.20210524.1714.004.html
[13]Neutralizing thepathological effects of extracellular histones with small polyanions .NATURECOMMUNICATIONS. 2020, 11:6408