急性髓系白血病(AML)可以是由化療和/或電離輻射後的治療相關併發症引發,被稱為治療相關AML(t-AML);也可以是既往血液疾病所致,被稱為繼發性AML(sAML),sAML約佔所有AML病例的四分之一。根據WHO 2016分類,透過骨髓增生異常綜合徵(MDS)、發育異常體徵和/或MDS相關細胞遺傳學異常病史定義為AML伴骨髓增生異常綜合徵相關細胞遺傳學異常(AML-MRC)。AML-MRC和sAML更常發生於高齡患者,與不良遺傳學和多藥耐藥表型等生物學特性相關;常規治療後臨床結局較差。
CPX-351是阿糖胞苷和柔紅黴素以5:1固定藥物比例的雙重藥物脂質體制劑。既往多項臨床研究已經證實了CPX-351在初診的sAML患者中的優異療效和良好的安全性;但真實世界經驗的資料與臨床試驗結果往往不完全相同。基於此,研究者們進行了一項使用CPX351作為AML患者一線治療的真實世界回顧性研究。
研究方法
該項回顧性分析納入了2018年至2020年間參加德國白血病研究聯盟(SAL)、德國移植合作研究組和AML研究組(AMLSG)的25家德國中心根據EMA標籤接受CPX-351治療的新診斷AML-MRC或t-AML患者的資料。每家臨床試驗機構納入的中位患者數為6例。
研究結果
1患者基線特徵
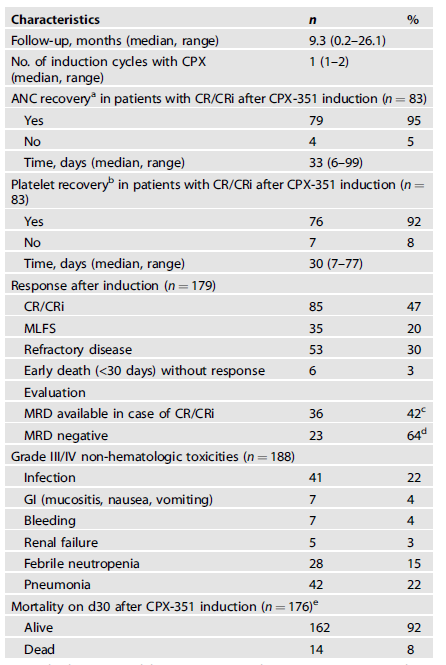
該研究共納入了188例AML患者,中位年齡為65歲(範圍為26-80歲),46例患者(24%)<60歲,詳細基線特徵見表1。其中t-AML佔29%、AML-MRC佔70%。大部分患者(82%)的體能狀態良好,Karnofsky指數≥80%,大部分(82%)伴有合併症,合併症指數(HCT-CI)為中或高。65%的患者存在核型異常,其中44例(25%)具有複雜核型(CK)。依據2017歐洲白血病網(ELN)風險分類中包括的預後相關突變,ASXL1是最常見的突變基因,佔16%,其次是RUNX1,佔13%,NPM1佔10%,TP53佔7%,FLT3-ITD佔7%。該研究患者中2017 ELN標準屬於預後良好、中等和不良的患者分別為7%、33%和60%。
表1:患者基線特徵
2治療情況
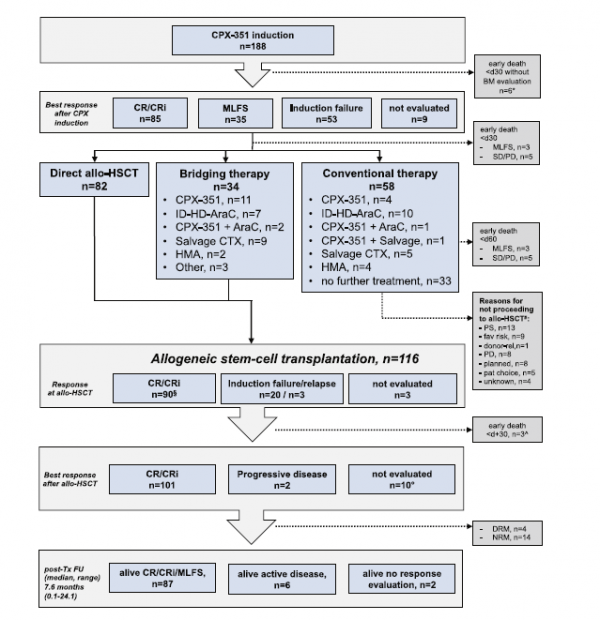
162例患者(86%)接受了1個週期的CPX-351誘導治療,26例患者(14%)接受了2個週期誘導治療(詳見表2)。其中116例(62%)患者接受了異基因造血幹細胞移植(Allo-SCT),82例患者未接受進一步治療;另外34例患者中至少進行了1個週期的由CPX-351和(或)阿糖胞苷(Ara-C)鞏固治療,以及去甲基化藥物(HMA)或挽救治療(圖1)。
3療效
誘導治療後,可評價患者中達到完全緩解(CR)/細胞計數未恢復的CR(CRi)率為47%,達到形態學無白血病狀態(MLFS)的比例為20%,未緩解患者的比例為30%。其中64%的患者達到微小殘留病(MRD)陰性(<10-3)(表2)。中位隨訪9.3個月,中位總生存期(OS)為21個月,1年OS率為64%。複雜核型患者(N=44)和TP53突變患者(N=14)的CR/CRi率分別為33%和54%。
4安全性
在CR/CRi患者中,分別在95%和92%的患者中觀察到中性粒細胞絕對計數(ANC)≥500/μl和血小板計數≥50000/μl(表2)。至ANC和血小板恢復的中位時間分別為33天(範圍:6-99天)和30天(範圍:7-77天)。關於非血液學毒性,130例患者(69%)報告≥3級不良事件(AE)。整個佇列的30天早期死亡率為8%,≥65歲患者的30天早期死亡率顯著更高(11% vs 3%,p=0.047)。總體而言,安全性情況與既往CPX-351的研究結果一致。
表2:患者治療特徵、反應和毒性
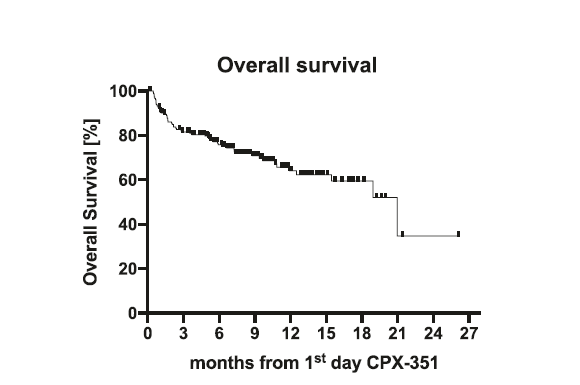
中位隨訪時間為9.3個月(範圍:0.2-26.1個月)整個佇列的中位OS為21個月,預估的1年OS率為64%(95% CI:55-72%)(圖2)。多變數分析結果顯示,複雜核型與較低的緩解率相關(P=0.0001),而接受HMA預治療(P=0.02)和具有不良細胞遺傳學風險(p<0.0001)與較短的OS相關(表3)。共有62%的患者接受了Allo-HSCT,該部分患者中位OS未達到,1年OS率為73%。
表3:患者在CPX-351誘導後的療效以及療效相關因素的多變數分析結果
總之,該項真實世界的研究資料顯示,CPX-351是AML-MRC和t-AML患者的一種有效且臨床相關的治療選擇。考慮到移植後的良好結局,應用CPX-351有效誘導達到MRD陰性的CR,隨後進行Allo-SCT可能是該高危人群治癒機率最高的治療方法。
參考文獻:Christina Rautenberg , Friedrich Stölzel , Christoph Röllig, et al. Real-world experience of CPX-351 as first-line treatment for patients with acute myeloid leukemia. Blood Cancer J. 2021 Oct 4;11(10):164.