輝瑞新冠口服藥物的分子設計的研發故事
輝瑞的新冠口服藥物PAXLOVID(核心成分為PF-07321332)展現了驚人療效,今天給大家分享下其研發歷程。PF-07321332的研發故事得追溯到輝瑞在SARS期間發現的PF-00835231。當時輝瑞已經研發出PF-00835231,但隨著SARS在2003年的結束,臨床研發終止了。
偶然?17年前的沉寂分子煥發新生
Rupintrivir是人鼻病毒(HRV)3C蛋白酶抑制劑(1999年發現),隨後有科學家解出了TGEV(冠狀病毒的一種)Mpro與rupintrivir的共晶結構。TGEV的晶體結構曾被用來同源建模SARS的3CL蛋白酶結構,當時有科學家認為rupintrivir有可能會是設計SARS的3CL蛋白酶抑制劑的先導化合物。然而,輝瑞的研究人員發現rupintrivir對SARS的3CL蛋白酶活性很弱。以rupintrivir為起點,在保留Michael acceptor的基礎上,研究人員隨後最佳化得到活性還可以的SARS-mol2分子(本質是替換了合適的氨基酸側鏈)。最後,對SARS-mol2經過一系列的SAR最佳化得到共價抑制劑PF-00835231(見圖2或圖3的化合物1)。2020年新冠爆發時,輝瑞發現SARS和SARS-CoV-2病毒的3CL蛋白酶在與底物結合的催化域中的序列100% 相同,因此重新撿起了這個17年前的分子繼續研發。
圖1. Rupintrivir與SARS-mol2的分子結構。
圖2. SARS-CoV-2-3CL蛋白酶與PF-00835231(和Cys145共價結合)的共晶結構(PDB:6XHM)。From: JMC
分子最佳化得到PF-07321332
如圖3所示,PF-00835231(即圖3的化合物1)的活性非常好且代謝穩定,但滲透性和口服利用度都很低,導致1很難口服給藥。為了改善1的滲透性和口服利用度,研究人員將1的α-羥甲基酮(因為較多氫鍵給體通常與口服生物利用度低有關)改為氰基得到化合物2。2的口服利用度F(1.4 vs. 7.6)和從胃腸道吸收的口服劑量分數Fa x Fg (3.3 vs. 38)都顯著提高,但活性明顯降低。隨後,研究人員同時引入氮雜雙環(模擬環狀Leu)和苯並噻唑,得到化合物3。如圖3所示,3的滲透性提升顯著(Papp:0.207 vs. 10.3),但3的氮雜雙環片段佔據了疏水口袋,使其無法與Gln189形成氫鍵(如圖4C所示),導致其活性遠不如1。研究人員觀察到3的吲哚片段並沒有很好的佔據口袋,為此他們將吲哚改為甲基磺醯胺,得到的化合物4與Gln189和Glu166都形成氫鍵,且各方面指標提升明顯(EC50=909 nM;F=10%;Fa x Fg =84)。
基於甲基磺醯胺的相互作用模式,研究者進一步最佳化得到含三氟乙醯胺的化合物5。5和4的Ki接近,但5的滲透性和EC50比4好10倍(Papp:13.1 vs. 1.56;EC50:85.3 nM vs. 909 nM),且5在老鼠和猴模型上的藥代動力學表現同樣優異(F分別為33%和7.9%;Fa x Fg分別為100%和66%)。最後,將5的苯並噻唑改為氰基即得到了臨床分子PF-07321332(即化合物6),6的活性和生物利用度進一步提升,且透過與SARS-CoV-2-3CL蛋白酶的孵育實驗發現6是可逆共價抑制劑。由於6具有便於放大合成、更好的溶解性(便於簡單製劑研究毒理學)和降低差向異構化等優點,研究人員選擇6進入臨床。
圖3. SARS-CoV-2-3CL蛋白酶抑制劑的體外和體內參數。從左到右分別為3CL蛋白酶活性Ki、抗病毒活性EC50、通透性Papp、內在清除率CLint、血漿清除率CLp、口服生物利用度F和從胃腸道吸收的口服劑量的分數 (Fa x Fg)。
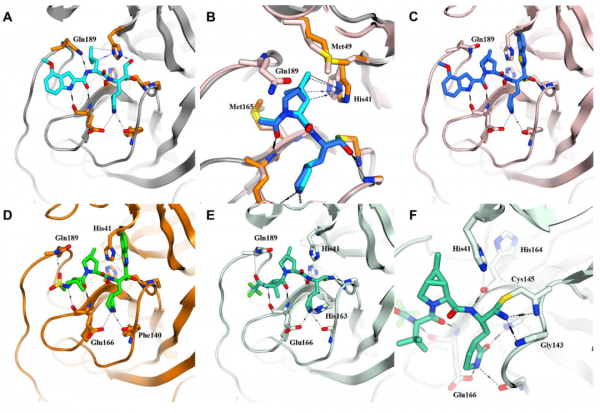
圖4.(A)SARS-CoV-2-3CL蛋白酶與化合物1的共晶結構。(B)化合物3的二甲基-雙環 [3.1.0]脯氨酸模型(藍色)與亮氨酸殘基(青色)的構象疊加。(C)化合物3有效地填充了由 Met49、Met165 和His41 形成的親脂性口袋,但不能與Gln189形成有效的氫鍵。(D)化合物4與Gln189和Glu166都形成氫鍵。(E)臨床候選 PF-07321332(化合物6)與 SARS-CoV-2-3CL蛋白酶結合的共晶結構。(F) Cys145與化合物6的可逆共價結合。
改善代謝得到臨床藥物PAXLOVID
探究PF-07321332的代謝時,研究人員發現加入CYP3A4/5抑制劑時,PF-07321332在人肝微粒體的內在消除率(CLint)會顯著下降(24.5 vs. <4.33);而且,CYP3A4 會對PF-07321332的多個位點(如叔丁基、氮雜雙環和吡咯烷酮)進行氧化代謝。這些結果表明CYP3A4對PF-07321332的代謝至關重要。為此,研究人員想透過與強效CYP3A4抑制劑利托那韋(RTV)共同給藥來提高臨床中PF-07321332治療濃度。利托那韋常用作蛋白酶抑制劑(如地瑞納韋、洛匹那韋等)的藥代動力學增強劑,這些蛋白酶抑制劑也是透過CYP3A4進行代謝清除。
圖5C顯示了單獨服用150mg PF-07321332和250mg PF-07321332+利托那韋獲得的成人初步血漿濃度與時間的藥代動力學曲線。PF-07321332 安全且耐受性良好,當與 RTV 共同給藥時,口服血漿濃度顯著增加且遠高於SARS-CoV-2抗病毒的EC90 值。
圖5. PF-07321332的臨床前毒理學和健康成人參與者單次上升劑量暴露研究。(A)每天一次給予PF-07321332的大鼠口服毒代動力學暴露(第14天)。(B)每天兩次給予PF-07321332的猴子口服毒代動力學暴露(第15天)。(C)成人口服150mg PF-07321332和250mg PF-07321332+利托那韋RTV的血漿濃度。(D)成人口服250mg PF-07321332和100mg利托那韋(t = -12、0、12小時)12小時內的血漿濃度 。
小結
PF-07321332的發現始於輝瑞在SARS期間的工作,雖然有偶然性,但充分展現了公司深厚的科研底蘊。輝瑞的科學家以擬肽rupintrivir為起點,透過替換類氨基酸殘基側鏈得到先導化合物SARS-mol2分子。隨後經過經典的SAR得到了活性很好的PF-00835231,再基於改善口服利用度的需求最佳化得到PF-07321332。最後透過藥代研究發現加入利托那韋能改善代謝消除率,得到臨床藥物PAXLOVID。
參考文獻:
1. Peter S. Dragovich, et al. "Structure-Based Design, Synthesis, and Biological Evaluation of Irreversible Human Rhinovirus 3C Protease Inhibitors. 4. Incorporation of P1 Lactam Moieties as l-Glutamine Replacements". J. Med. Chem. 1999, 42, 1213–1224
2. Robert L. Hoffman, et al. "Discovery of Ketone-Based Covalent Inhibitors of Coronavirus 3CL Proteases for the Potential Therapeutic Treatment of COVID-19". J. Med. Chem. 2020, 63, 21, 12725–12747