作者:科學聲音知識寫作訓練營 閆永明
引子:一種癌症和兩種病毒
1972 年 12 月8日,細雨濛濛,溫度宜人。位於佛羅里達州的比斯坎灣大酒店迎來了一批不尋常的客人[1]。他們不是普通的遊客,而是來自世界各國的40多位科學家。一場主題為“皰疹病毒與宮頸癌”的學術會議,將在這裡舉行。
隨著會議程序的推進,一個又一個證據被科學家們丟擲來,大家的討論也從激烈的爭論逐漸變成友好的探討,似乎用不了多長時間,就能達成共識。但是,坐在角落裡的一名年輕人卻表現出不安的神色,他幾次動了動嘴角想說什麼,卻又忍了回去。
終於輪到他發言了。年輕人定了定神,堅定地說道:“我們用最新方法對大量宮頸癌活檢組織進行了檢測,但從未發現過皰疹病毒。所以,我傾向於認為皰疹病毒並非宮頸癌的病因。”他頓了頓,提高了音調接著說:“從我們掌握的臨床資料來看,反而人乳頭瘤病毒 HPV 的嫌疑更大。”
發言的年輕人是德國埃朗根大學病毒研究所的主席,年僅 36 歲的哈拉爾德·楚爾·豪森。他本以為,這種與眾不同的觀點肯定會引起高度重視。但他失望了,熱鬧的會場突然陷入了寂靜。大家都像陌生人一樣注視著他,竟然沒有一個人說話。
終於,來自芝加哥大學的病毒學家伯納德·羅伊茲曼打破了沉默。他緩緩說道:“沒檢測到皰疹病毒,這並不奇怪。實驗方法不對,或者精度不夠,都可能導致這種結果。但是,我們在宮頸癌細胞中發現了 39% 的皰疹病毒基因片段[2],是經得起考驗的。你懷疑 HPV 是宮頸癌的病因,能拿出同樣的證據嗎?”
羅伊茲曼顯然道出了大家的心聲,也拯救了尷尬的會場氣氛。於是,熱烈的討論聲重新響起,再也沒人關心剛才那個唱反調的年輕人。
那麼,宮頸癌究竟是何方妖魔?為何能跟兩種病毒扯上關係?到底是哪種病毒,才是引發宮頸癌的真兇?這是一個長長的故事,請讓我從一位著名的女病人開始講起。
紅顏殺手
我們要講的這個人名叫埃達·洛夫萊斯。她是詩人拜倫和數學家伊莎貝拉的女兒。也許與基因和家庭環境有關,埃達具備了數學家和詩人的雙重氣質。她用富有詩意的語言,第一次系統地描述了程式設計思想。因此,她也被稱為世界上第一位程式設計師。
然而,世事無常。1851 年的春天,正處在生活與事業上升期的埃達突然得了一種怪病。她先是出現間歇性的發熱,隨後又出現下體大量出血的症狀。醫生給她開了奎寧、硝酸銀、水蛭和補血劑進行對症治療,但是症狀不僅沒有改善,反而繼續惡化。很快,疼痛就開始變得無法忍受。
無奈之下,醫生對她進行了當時還沒有普及的婦科檢查,並在她的生殖器中發現了一種像“瘡”一樣的病變。為了止痛,醫生把鴉片、大麻、氯仿甚至催眠術都用上了,但仍無濟於事。
在她生命的最後幾個月裡,除了忍受劇痛,她還出現了抽搐、嘔吐的症狀,嚴重的時候還會產生精神錯亂。她每天的生活都在暈厥和劇痛的迴圈中度過。但即便如此,埃達還是用程式設計師式的嚴謹,把她與疾病的抗爭記錄了下來。
1852 年 11 月,也就是症狀出現的僅僅 18 個月後,埃達在一次昏迷中一睡不醒,年僅 36 歲。
這種可怕的疾病,就是被稱為“紅顏殺手”的宮頸癌。直到今天,宮頸癌仍是全球女性的第四大常患癌症。僅 2020 年就產生了大約 60 萬個新發病例,造成了 34 萬名婦女死亡[3]。然而,在相當長的一段時間內,宮頸癌一直與其他婦科疾病混淆在一起,別說預防和治療了,就連診斷都是個問題。直到 19 世紀,人們對這種疾病才有了初步的認識。
癌症可以傳染
1842 年,義大利醫生多梅尼科·裡戈尼-斯特恩發現:宮頸癌在妓女中相對常見,但在修女中卻聞所未聞。這使人們意識到,宮頸癌可能與某種性傳播媒介有關。但這只是一個統計結果。按照當時的主流觀點,癌症僅僅是異常生長的身體細胞而已。既然是細胞,又怎麼可能傳染呢?這讓科學家們百思不得其解。直到 20 世紀初,一項與人類癌症無關的意外發現,才把宮頸癌病因的研究引到了正確的方向。
1911 年,美國病毒學家佩頓·勞斯發現,用一種生長在母雞身上的惡性肉瘤製取的無細胞濾液,可以使健康的雞患上同樣的腫瘤。後來,他和同事又在兔子身上找到了類似的現象。這些發現不僅顛覆了“癌症不能傳染”的傳統認知,而且把癌症背後的傳染因子明確指向了一種比細菌還要小成百上千倍的微生物——病毒。
那麼,病毒又是如何導致癌症的呢?進一步的研究發現,病毒在侵入正常細胞後,有的會迅速複製,導致細胞裂解;但有些時候,它們會脫掉外殼,將遺傳物質整合進細胞的基因組中,悄無聲息地與宿主一起復制。這些被病毒潛伏的細胞會因此而改變性質,最終在其他風險因素的誘導下,發展成不受控制的癌細胞。
這些發現為陷入僵局的癌症病因研究打開了一扇新的大門。很快,科學家們就在動物和人體中,找到了更多病毒致癌的案例。而宮頸癌這種與性傳播媒介有關的高發癌症,更是迅速成為研究熱點。但是,與性傳播有關的病毒也有很多,該從哪個下手呢?
鎖定可疑目標
20 世紀 60年 代,美國爆發了一場聲勢浩大的性解放運動,各種性傳播疾病的發病率也迅速攀升。其中,由 2 型單純皰疹病毒引起的生殖器皰疹是最常見的性傳播疾病之一。
1968 年,美國醫生威廉·羅爾斯在《科學》雜誌上發表的一篇重磅論文,給人們敲響了警鐘。研究發現,在 18 名宮頸癌患者中,有 15 名患者都曾經感染過 2 型單純皰疹病毒,比例高達 83%,遠遠高於對照組[4]。這說明,宮頸癌與 2 型單純皰疹病毒高度相關。同一時期,還有多項研究也都支援這一結論。所以,皰疹病毒很快就成了引發宮頸癌的第一懷疑物件。
但是我們的主人公——德國病毒學家楚爾·豪森——卻並不看好這一結論。一來,他覺得相關性並不等於因果關係;二來,一篇綜述性文章把他的注意力引到了另外一個截然不同的方向。

圖:年輕時的楚爾·豪森(圖片來源:Zur Hausen H, 2019)
那是一篇來自《細菌評論》(Bacteriological Reviews)上的關於乳頭瘤病毒的綜述[5]。乳頭瘤病毒是一大類病毒的統稱,很多種哺乳動物都是它們的易感宿主,例如老鼠、兔子、豬、牛、羊等,人也不例外。其中,感染人的那一類就統稱為“人乳頭瘤病毒”,簡稱 HPV(Human Papilloma Virus)。人感染 HPV 後,面板上就可能長出贅生物,醫學上叫做“疣”,我們生活中常見的“瘊子”,就是疣的一種。它們常常長在手或腳上,但也會在其他部位出現, 例如面部、軀幹和生殖器。
早在 1907 年,就有科學家發揮大無畏的犧牲精神,把疣組織製成的無細胞濾液接種在自己身上,成功地證明了疣的傳染性[6]。但即便如此,這種面板病還是很少受到關注,因為它們太常見了,而且一般也不會產生什麼嚴重後果。
但《細菌評論》上的這篇文章卻指出:由 HPV 導致的生殖器疣有時會轉變成惡性的鱗狀細胞癌,而大部分宮頸癌都屬於鱗狀細胞癌。由此楚爾·豪森推測:HPV 能夠長期與宿主共存,也有明確的良性轉成惡性的病例,它比皰疹病毒更有可能是導致宮頸癌的罪魁禍首。
回應開篇
但是,猜測是沒有任何說服力的,必須用實驗資料說話。他需要做的第一步,就是驗證當時的主流觀點,看看宮頸癌細胞中到底有沒有皰疹病毒 DNA。具體該怎麼做呢?他把目光瞄準了剛剛發明的 DNA 分子雜交技術。
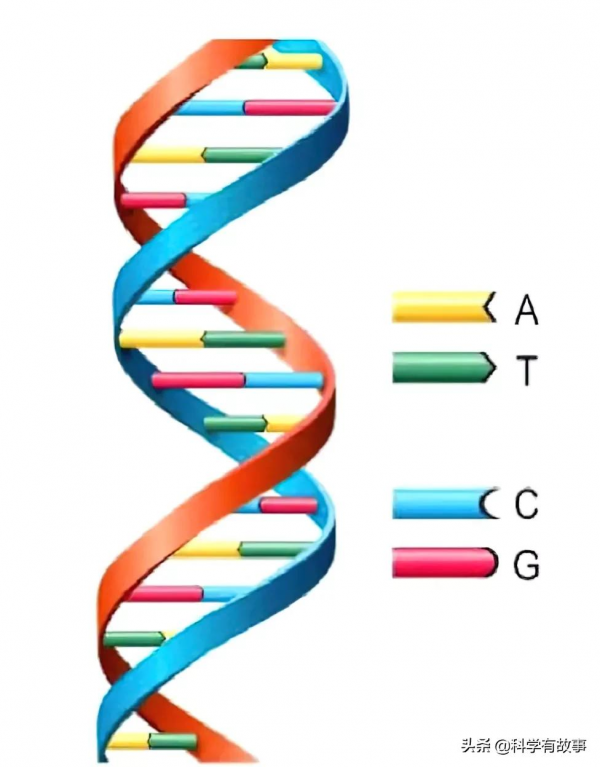
我們知道,DNA 分子就像一架旋轉的螺旋形樓梯,由一對各不相同但又完全互補的雙鏈組成[7]。當對其進行加熱時,DNA 分子會分解成兩條單鏈;恢復適宜條件時它們又會重新結合在一起。利用這個特性,科學家就能達到檢測病毒 DNA 的目的。
假如我們把病毒 DNA 想象成一把鑰匙,那麼感染了這種病毒的細胞中,就必然存在一把與之配對的鎖。這樣,科學家就可以弄一堆鑰匙,與被檢測的細胞 DNA 充分反應,如果發生配對,就意味著被檢測的細胞已經被病毒 DNA 侵染。反之則沒有。那問題又來了,怎麼知道有沒有發生配對呢?也很簡單,事先用放射性同位素給鑰匙做上標記,然後把沒發生配對的鑰匙沖洗掉。如果剩下的部分有放射性,就說明發生了配對,反之就說明沒有。這些鑰匙,就叫做 DNA 探針;而這個過程,就叫做 DNA 分子雜交。
有了這項技術,楚爾·豪森做的第一件事就是看看“2 型單純皰疹病毒導致宮頸癌”的猜測靠不靠譜。為了覆蓋大多數腫瘤細胞,他仔細挑選了 10 例宮頸癌活檢組織,提取出細胞 DNA。然後,又從一位研究皰疹病毒的朋友那裡搞了一些病毒樣本,製成放射性探針。當楚爾·豪森把探針加入細胞 DNA 中,觀察是否發生雜交反應時,你猜怎麼著?10 例樣本的 DNA 雜交實驗結果居然都是陰性的[8]!這樣的結果,更讓楚爾·豪森對 HPV 寄予厚望。
但凡事總有例外。1972 年,美國芝加哥大學病毒學家羅伊茲曼得出了完全相反的結果,他在一例宮頸癌樣本中發現了 39% 的 2 型單純皰疹病毒 DNA 片段。他的實驗結果是陽性的。眾所周知,基因證據是最硬核的生物學證據之一。在宮頸癌細胞樣本中找到了病毒 DNA,就好像在案發現場找到了嫌疑犯的指紋一樣,剩下的事情不過就是把他捉拿歸案而已。
支援這一觀點的科學家幾乎就要開香檳慶祝勝利了。不過,出於科學家們特有的謹慎,他們決定年底在位於佛羅里達州的比斯坎灣大酒店開個研討會,對皰疹病毒與宮頸癌進行一次深入交流。比斯坎灣不僅是個開會的場所,更是美國冬季數一數二的度假勝地。從會議選址就看得出來,如果研討會一切順利,就可以順便擺一桌慶功宴了。
這樣的架勢,讓媒體們也有點兒按捺不住了。《紐約時報》還專門撰寫了一篇報道,題目就是《一種與癌症有關的新病毒》[9],他們在科學家下結論之前,就添油加醋地向社會公開了這項研究成果。
然後,就是我們本文開頭的那段故事了。在楚爾·豪森看來,不管是他的陰性實驗結果,還是羅伊茲曼的陽性結果,都還遠遠沒有解決問題。要想對這件事下結論,就必須拿出更多的證據。於是,他也參加了比斯坎會議。不過,他可不是去開慶功會的,他想透過自己的實驗來提醒大家——有必要關注一下 HPV 這個新的方向。
但是,正如你在本文開頭見到的那樣,向來講究用證據說話的科學家們並不買賬。因為楚爾·豪森的實驗,只是證明沒有皰疹病毒參與而已。對於 HPV 這個方向,楚爾·豪森自己都必須承認,還沒有找到硬核的證據。所以,他的觀點也幾乎沒人重視。
辛苦的突破
回到德國後,楚爾·豪森立即把關於皰疹病毒的實驗過程重新檢查了一遍。確認無誤後,他很快就從陰霾中走了出來。他安慰自己說:“沒人關注也不是壞事,至少還沒人和我們競爭呢[10]。”下一步,他決定用同樣的實驗方法,看看宮頸癌細胞中有沒有 HPV 的 DNA。
楚爾·豪森設計的實驗是這樣的:他從最常見的腳疣中提取出 HPV,並製成放射性探針。為了確保實驗的可靠性,他把探針分別加入其他普通疣、生殖器疣和宮頸癌的細胞 DNA 中,觀察它們之間的雜交反應。楚爾·豪森的想法是,普通疣和生殖器疣中含有 HPV 病毒顆粒,這是已經確認過的事實。探針在這些已經確認病毒存在的細胞中,必然會呈現出陽性結果。這樣,宮頸癌細胞中的實驗結果就會更加準確。
但是,實驗結果完全不符合他的預期。除了普通疣顯示弱陽性外,生殖器疣和宮頸癌都是陰性結果[11]。這個意外發現讓楚爾·豪森意識到,要麼是實驗過程出了問題,要麼就是腳疣裡的 HPV 與生殖器疣裡的根本不是同一種。雖然實驗沒有達到預期目標,但是事情變得越來越有趣了。
為了驗證自己的猜測,楚爾·豪森讓學生更大規模地收集腳疣和其他普通疣的組織樣本,提取其中的病毒 DNA 並分析其結構。很快他們就證實,根據基因結構的不同,HPV 確實可以分為不同型別。到 1976 年,他的團隊就已經分離出 4 種 HPV 亞型,按發現順序分別命名為 HPV 1-4。[12]利用這些病毒 DNA 做成的探針,他們又在四年後從生殖器疣中檢測出了 HPV 6 。[13]
聯想到之前文獻中生殖器疣惡變的記錄,楚爾·豪森滿懷希望地以為:宮頸癌很可能與生殖器疣一樣,致病源也是 HPV 6。但是,雜交實驗結果還是陰性,HPV 6 探針並沒有與宮頸癌細胞 DNA 發生反應。要麼仍有其他的 HPV 亞型存在,要麼宮頸癌與 HPV 沒有關係。由於缺少必要的研究方法,楚爾·豪森的實驗再次陷入了僵局。
就在這時,DNA 分子雜交技術的升級版出現了。有科學家發現:如果降低反應溫度和某些化學物質的濃度,DNA 探針這把鑰匙的容錯率就會提高。以前是隻有精確匹配的鎖才能完成配對,現在只要有相似的 DNA 序列,就能完成雜交。尋找近似的 DNA 片段,這正是楚爾·豪森需要的技術。
此後的一段時間裡,楚爾·豪森帶領團隊不斷地用已知型別的 HPV 探針與各種乳頭瘤和可疑腫瘤細胞進行雜交實驗。這個過程,就像一個不斷迴圈的排列組合遊戲。降低匹配精確度,可以幫助發現新的 HPV 亞型;而新病毒亞型做成的探針,又可以開啟新一輪的實驗,發現更多的 HPV 亞型……終於,功夫不負有心人,在無數次失敗後,他的團隊成功地從兒童喉乳頭瘤中鑑定出了一種新型的 HPV,按照順序,這已經是第11種 HPV 亞型了[14]。
1982年11月12日,楚爾·豪森的博士生馬提亞·德斯特坐在實驗室裡,嘗試在低強度條件下,讓HPV 11探針與宮頸癌細胞 DNA 進行雜交。這時,最激動人心的高光時刻到了——探針竟然與目標中的幾個 DNA 序列都發生了雜交!這意味著,有一種與HPV 11相似度很高的新亞型,潛伏在宮頸癌細胞當中!很快,這種新亞型就被輕車熟路的德斯特揪了出來,按照規則,它被命名為 HPV 16。

圖:馬提亞·德斯特(圖片來源:Zur Hausen H, 2019)
當德斯特把這個訊息告訴楚爾·豪森的時候,楚爾·豪森愣了一下。他隨即走到櫥櫃前,拿出一瓶白蘭地,平靜地說:“也許,我們應該乾一杯。”
是的,確實應該乾一杯。沒有人知道,這十多年裡他頂住了多大的壓力。雖然他的團隊已經在對 HPV 的認知上產生了不少成果,但是對於 HPV 與宮頸癌之間的關聯,這還是第一個實質性突破。
沒過多久,他們又在宮頸癌細胞中發現了 HPV18,這些實驗結果也很快發表在頂級期刊上[15][16]。然而,故事進行到這裡就結束了嗎?並沒有。因為楚爾·豪森只是在癌細胞中找到了病毒 DNA,但還沒有證明二者的因果關係。這就好像在案發現場找到一個指紋,但並不能據此斷定指紋的主人就是兇手一樣。
最終的勝利
那麼,要怎樣才能證明 HPV 與宮頸癌的因果關係呢?我的老讀者已經猜到了,最簡單的辦法就是按照科赫法則的要求,完成一個“尋找病原體”、“分離病原體”、“接種病原體導致健康宿主患病”、“再次分離病原體”的完整迴圈。
但是,說起來容易做起來難。楚爾·豪森遇到的第一個障礙是,在當時的條件下, HPV 根本無法體外培養[17]。另一個障礙是,乳頭瘤病毒對宿主具有嚴格的特異性,能感染人類的 HPV 通常不能感染用來實驗的動物;而由於癌症的高風險性,更不可能直接用人體做實驗[18]。為了繞過這兩個障礙,楚爾·豪森決定另闢蹊徑,從基因層面尋找答案。
1983 年,楚爾·豪森的團隊發現,HPV18 的 DNA 是一個環形結構。當它們整合進細胞時,會開啟成為線形。在這個過程中,代號為 E2 的基因總被破壞,而 E6 和 E7 兩個基因卻總被保留下來。因此,楚爾·豪森斷定:這兩個基因肯定有問題!難道,它們就是導致細胞癌變的幕後黑手?如果真是這樣,那就一定能找到這兩個基因被活躍表達的中間產物——信使 RNA。
有了這個思路,實驗就是順理成章的了。他們利用 E6 和 E7 製作的放射性探針,果然在宮頸癌細胞中檢測到了對應的信使 RNA,這兩個基因的表達被證實了[19]。隨後,他們又用反義 RNA 中和了這些信使 RNA,阻斷了 E6 和 E7 的表達,結果癌細胞竟然奇蹟般地停止了生長[20]!
至此,所有的證據終於形成了一個閉環。宮頸癌病因這一困擾了醫學界一個多世紀的難題,也圓滿地劃上了句號。
2008 年 12 月 10 日,楚爾·豪森因為他對宮頸癌病因的研究,在瑞典斯德哥爾摩音樂廳被授予諾貝爾生理或醫學獎。歷史總是驚人地巧合,這一天與 36 年前比斯坎會議的落幕正是同一天。
尾聲
宮頸癌病因的確認,吸引了越來越多的科學家投入到這個領域中,人們對於 HPV 與宮頸癌的關係也逐漸有了更多的認識。現在,人類已經發現了 400 多種 HPV,其中有致癌作用的除了 HPV16 和 HPV18 外,也增加到了十幾種,它們被統稱為高危亞型[21]。
幸運的是,即便是感染了 HPV 高危亞型,也不意味著一定會得宮頸癌。大多數情況下,病毒都能被免疫系統清除。只有長期的持續感染,才可能導致宮頸癌。因此,成年健康女性只要透過定期接受宮頸塗片篩查或 HPV 基因檢測,就能達到很好的預防效果。
另一方面,由於 HPV 高危亞型相對較少,這就為透過疫苗來預防宮頸癌提供了可能。目前,全球已經研製出三種 HPV 疫苗,分別為二價、四價和九價。雖然不同的價數針對著不同的病毒種類數量,但是它們都覆蓋了 HPV16 和 18 這兩種最常見的高危亞型,至少能預防 70% 的宮頸癌。經過長期監測,也都展現了優秀的保護率和安全性[22]。因此,適齡女性積極接種 HPV 疫苗,也是預防宮頸癌的有效措施。
2020 年 11 月 17 日,世界衛生組織正式啟動了“加速消除宮頸癌全球戰略”。全球 194 個國家共同商定,要終結這一可防可治的疾病[23],這是人類第一次擁有了消滅一種癌症的能力。寫到這裡,我不禁感嘆:這其中的絕大多數成就,都發生在過去的短短 100 多年;這場史詩級勝利的背後,是現代醫學的飛速發展和無數科學家、醫生乃至企業家的辛苦付出。
今天之所以跟大家講這個故事,其實是有感於經常在社會上聽到的一些奇談怪論,說現代醫學是還原論,古代醫學是整體論,整體論要高於還原論。但我想說,透過貼一個簡單的標籤,然後就用標籤對標籤的方式進行比較,這是一種尚未脫離矇昧的思考方式。現代醫學的大量研究成果,可不是把人還原成原子,而是一種透過系統實驗來尋找確定因果關係的科學方法,透過這種方法得出的結論是可靠的,經得起無數次的重複驗證,並且最終也幫助人類戰勝了一個又一個疾病。宮頸癌的尋兇之旅就是對這種方法的最好詮釋,希望大家能在聽完故事之後,得到一些思維上的啟迪,因為,比科學故事更重要的是科學精神。
作者閆永明的“結尾廢話”
寫完這一稿,我終於長長地吁了一口氣。這篇文章佔據了我兩個月以來幾乎所有的業餘時間。僅整理出來的部分中英對照參考資料,就超過了 30 萬字。但即便如此,依然很難保證不被專業人士揪出問題。我深刻地感受到,科普不易,負責任的科普更是不易。同時,也對孜孜不倦播撒科學種子的職業科普人萌發由衷的敬意。
正如大師兄董軼強所言,經過這次作業,每個人都要被扒一層皮。
然而,經過無數次痛苦的煎熬之後,我收穫的是脫胎換骨般的驚喜。雖然這只是一個開始,但這個過程對自己固有思考和表達模式的衝擊,必將使我終生受益。最後,衷心感謝汪老師的悉心指導和大師兄撥冗潤色,後面的作業——唉,繼續努力
信源
- 關於這個日期的年份,主要有兩個版本,一說1972年,一說1974年。透過查閱本次會議的論文專輯確定,應為1972年。詳見:https://cancerres.aacrjournals.org/content/33/6/1345。
- Frenkel N, Roizman B, Cassai E, et al. A DNA fragment of herpes simplex 2 and its transcription in human cervical cancer tissue[J]. Proceedings of the National Academy of Sciences, 1972, 69(12): 3784-3789.
- https://gco.iarc.fr/today
- Rawls W E, Tompkins W A F, Figueroa M E, et al. Herpesvirus type 2: association with carcinoma of the cervix[J]. Science, 1968, 161(3847): 1255-1256.
- Rowson K E, Mahy B W. Human papova (wart) virus[J]. Bacteriological reviews, 1967, 31(2): 110-131.
- Ciuffo G. Innesto positivo con filtrato di verruca volgare[J]. Giorn Ital Mal Venereol, 1907, 48(1): 12-17.
- Watson J D, Crick F H C. Molecular structure of nucleic acids: a structure for deoxyribose nucleic acid[J]. Nature, 1953, 171(4356): 737-738.
- Zur Hausen J, Schulte-Holthausen H, Wolf H J, et al. Attempts to detect virus-specific DNA in human tumors. II. Nucleic acid hybridizations with complementary RNA of human herpes group viruses[J]. International journal of cancer, 1974, 13(5): 657-664.1972年底比斯坎會議時,楚爾·豪森只是得出了HSV-2轉錄RNA與宮頸癌細胞DNA雜交實驗的陰性結果,但尚未發表,該結果正式發表於1974年。同年發表的還有另一個姐妹實驗,即足底疣病毒轉錄RNA與普通疣、生殖器疣、喉乳頭瘤、宮頸癌、霍奇金淋巴瘤患者脾臟細胞、卡波西肉瘤DNA的雜交實驗,見參考文獻11
- Harold M. Schmeck, Jr., “A New Virus Link with Cancer Seen; Scientists Find a Material That Could Start Disease,” New York Times, November 11, 1972, 25.
- Zur Hausen and Reuter, Gegen Krebs, 119.
- Hausen H Z, Meinhof W, Scheiber W, et al. Attempts to detect virus‐specific DNA in human tumors. I. Nucleic acid hybridizations with complementary RNA of human wart virus[J]. International journal of cancer, 1974, 13(5): 650-656.
- Gissmann L, Pfister H, Zur Hausen H. Human papilloma viruses (HPV): characterization of four different isolates[J]. Virology, 1977, 76(2): 569-580.
- Gissmann L, Hausen H Z. Partial characterization of viral DNA from human genital warts (Condylomata acuminata)[J]. International Journal of Cancer, 1980, 25(5): 605-609.
- Gissmann L, Diehl V, Schultz-Coulon H J, et al. Molecular cloning and characterization of human papilloma virus DNA derived from a laryngeal papilloma[J]. Journal of virology, 1982, 44(1): 393-400.
- Dürst M, Gissmann L, Ikenberg H, et al. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions[J]. Proceedings of the National Academy of Sciences, 1983, 80(12): 3812-3815.
- Boshart M, Gissmann L, Ikenberg H, et al. A new type of papillomavirus DNA, its presence in genital cancer biopsies and in cell lines derived from cervical cancer[J]. The EMBO journal, 1984, 3(5): 1151-1157.
- 直到20世紀90年代,人們才發現HPV難以進行實驗室的原因:它們只適應於在面板組織中生長,而面板組織有不同性質的細胞層。基於這一認識,直到1992年,科學家才發明了一種模擬面板組織結構的HPV培養裝置。見:Meyers C, Frattini M G, Hudson J B, et al. Biosynthesis of human papillomavirus from a continuous cell line upon epithelial differentiation[J]. Science, 1992, 257(5072): 971-973.
- 後來,人們培育了一種具有免疫缺陷小鼠,它們不會排斥移植的人體組織,因此可用於無法在人體開展的實驗。但直到20世紀90年代,這種技術才逐漸開始成熟。見:鄭亞偉, 郝莎, 胡林萍, 等. 免疫缺陷小鼠和人源化小鼠模型的發展及其在血液學研究中的應用[J]. Chinese Journal of Hematology, 2015, 36(11): 966.
- Schwarz E, Freese U K, Gissmann L, et al. Structure and transcription of human papillomavirus sequences in cervical carcinoma cells[J]. Nature, 1985, 314(6006): 111-114.
- von Knebel Doeberitz M, Oltersdorf T, Schwarz E, et al. Correlation of modified human papilloma virus early gene expression with altered growth properties in C4-1 cervical carcinoma cells[J]. Cancer Research, 1988, 48(13): 3780-3786.
- Roden R, Wu T C. How will HPV vaccines affect cervical cancer?[J]. Nature Reviews Cancer, 2006, 6(10): 753-763.
- World Health Organization. Human papillomavirus vaccines: WHO position paper, May 2017–Recommendations[J]. Vaccine, 2017, 35(43): 5753-5755.
- https://www.who.int/zh/news-room/events/detail/2020/11/17/default-calendar/launch-of-the-global-strategy-to-accelerate-the-elimination-of-cervical-cancer