糖尿病(Diabetes mellitus, DM)是一組以高血糖為特徵的代謝性疾病,主要由於胰島素(Insulin)分泌不足或外周組織胰島素利用率下降,從而造成機體血糖調節失衡引發高血糖,並在發病後期導致周圍器官病變的多基因疾病【1】。隨著生活水平的不斷提高,糖尿病的患病人數迅速增加,龐大的糖尿病患者群體給家庭和社會帶來了沉重的負擔。而目前針對該類疾病無有效治療方法,明確糖尿病的發病機制可有助於早期診斷和疾病治療研究。
近期,電子科技大學附屬醫院·四川省人民醫院人類疾病基因四川省重點實驗室朱獻軍教授研究團隊在糖尿病相關的胰島素分泌研究方面取得突破,發現了Tmem30a調控胰島素分泌的重要機制,成果以研究論文The phosphatidylserine flippase β-subunit Tmem30a is essential for normal insulin maturation and secretion發表於Molecular Therapy【2】。文章透過構建基因敲除小鼠模型以及相關細胞生物學研究,證明Tmem30a是胰島素分泌的重要調節因子,同時也強調了Tmem30a對於細胞囊泡轉運、血糖控制和代謝穩態中的重要性。
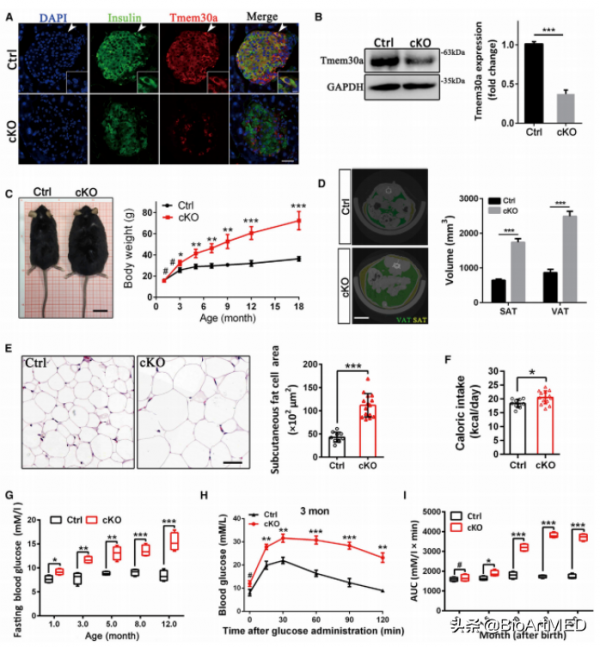
在真核生物中,細胞膜和胞內細胞器膜脂類分佈是不對稱的,這種不對稱分佈需要膜上磷脂內翻酶(Flippase)的動態調節。P型ATP酶第四類亞型(P4-ATP酶)被證明有磷脂內翻酶活性,能夠依賴ATP供能將磷脂醯絲氨酸(PS)和磷脂醯乙醇胺(PE)特異地向細胞膜內側面翻轉【3】。哺乳動物基因組編碼14種P4-ATP酶,它們組織表達冗餘,為功能研究帶來挑戰。而Tmem30a可結合多個P4-ATP酶,在組織發育過程中有重要作用。朱獻軍教授研究團隊近年來陸續在視網膜【4, 5】、小腦【6】、肝臟【7】、血管【8】,腎臟【9】以及肌肉【10】中證明了其重要性。磷脂內翻酶ATP10A和ATP10D突變已被證實與糖尿病相關,但具體致病機制尚不明瞭。糖尿病與胰島β細胞功能損害相關,為了探究其致病機制,研究團隊將Tmem30a在胰島β細胞中特異敲除,首先證明了TMEM30A在小鼠胰腺β細胞敲除可導致明顯的II型糖尿病表徵:胰島素分泌不足、葡萄糖不耐受、胰島素抵抗、胰島增生、肥胖以及肝臟損傷等疾病表型(圖1),表明該基因敲除小鼠可作為理想的II型糖尿病動物模型。
圖1. Tmem30a胰島β細胞敲除小鼠表現出高血糖等2型糖尿病表徵
為了進一步研究疾病機制,研究團隊採用離體胰島以及MIN6細胞系進行一系列分子細胞實驗。結果表明Tmem30a缺失的胰島β細胞內胰島素含量顯著下調,而胰島素原與胰島素比值升高,表明胰島素的剪下成熟過程受損。細胞免疫染色結果顯示胰島素顆粒異常聚集於高爾基體,提示胰島素分泌囊泡在高爾基體出芽釋放失敗(圖2)。另一方面,研究團隊發現葡萄糖轉運蛋白2 (GLUT2)異常聚集於細胞質,並伴隨成熟糖基化Glut2表達下調,表明其成熟和膜向轉運受阻,並導致後續β細胞的鈣離子內流減少以及細胞膜電位去極化消失,提示高糖感應的級聯反應喪失(圖3)。
圖2. Tmem30a缺失導致胰島素分泌缺陷
圖3. Tmem30a敲除透過阻止Glut2成熟而導致β細胞高糖感應受損
研究團隊進一步對分子機制進行了探索,發現Tmem30a透過調控特異的P4-ATP酶,對於網格蛋白(Clathrin)介導的囊泡轉運至關重要。Tmem30a缺失導致Clathrin表達下調,並在高爾基體異常聚集,其介導的細胞內吞過程也受到影響,證明Tmem30a參與該囊泡轉運途徑(圖4)。由於該途徑受阻進而影響到胰島素囊泡分泌以及Glut2的膜向轉運,最終導致胰島素釋放減少以及後續的糖尿病表型。這些資料證明了Tmem30a在胰島素成熟分泌和糖代謝穩態中的新作用,探明瞭Tmem30a及其互作P4-ATP酶所參與的蛋白囊泡轉運途徑,並揭示了P4-ATP酶相關的糖尿病的致病機制。
圖4. Tmem30a參與Clathrin介導的囊泡轉運過程
朱獻軍教授和帥平副研究員為本文的通訊作者。文章第一作者為電子科技大學醫學院博士後楊業明。
原文連結:
https://www.sciencedirect.com/science/article/pii/S1525001621002148
製版人:十一
參考文獻
1. Z. Fu, E. R Gilbert, D. Liu. Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes [J]. Current diabetes reviews, 2013, 9(1): 25-53.
2. Yang Y , Sun K , Liu W , et al. The phosphatidylserine flippase β-subunit Tmem30a is essential for normal insulin maturation and secretion[J]. Molecular Therapy, 2021.
3. V. A. van der Mark, R. P. Elferink, C. C. Paulusma. P4 ATPases: flippases in health and disease [J]. Int J Mol Sci, 2013, 14(4): 7897-7922
4. Zhang L , Yang Y , Li S , et al. Loss of Tmem30a leads to photoreceptor degeneration[J]. Rep, 2017, 7(1):9296.
5. Yang Y , Liu W , Sun K , et al. Tmem30a deficiency leads to retinal rod bipolar cell degeneration.[J].Journal of Neurochemistry, 2018.
6. Yang Y , Sun K , Liu W , et al. Disruption of Tmem30a results in cerebellar ataxia and degeneration of Purkinje cells[J]. Cell Death & Disease, 2018, 9(9):899.
7. Liu L , Zhang L , Zhang L , et al. Hepatic Tmem30a Deficiency Causes Intrahepatic Cholestasis by Impairing Expression and Localization of Bile Salt Transporters[J]. American Journal of Pathology, 2017:S0002944017304856.
8.Shanshan, Zhang, Wenjing, Liu et al. TMEM30A deficiency in endothelial cells impairs cell proliferation and angiogenesis.[J]. Journal of cell science, 2019.
9. Liu W , Peng L , Tian W , et al. Loss of phosphatidylserine flippase β-subunit Tmem30a in podocytes leads to albuminuria and glomerulosclerosis[J]. Disease Models and Mechanisms, 2021.
10. Kuan xiang Sun, Xiao yan Jiang, Xiao Li, et al. Deletion of phosphatidylserine flippase β-subunit Tmem30a in satellite cells leads to delayed skeletal muscle regeneration[J]. Zoological Research, 42(5):650-659.
轉載須知
【非原創文章】本文著作權歸文章作者所有,歡迎個人轉發分享,未經允許禁止轉載,作者擁有所有法定權利,違者必究。