喜歡就關注我們吧,訂閱更多最新訊息

第一作者:Michael J. Trenerry,Christian M. Wallen.
通訊作者:John F. Berry
通訊單位:威斯康星大學麥迪遜分校
論文DOI:https://doi.org/10.1038/s41557-021-00797-w
全文速覽
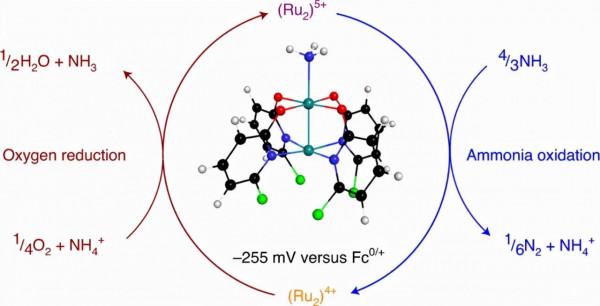
直接氨燃料電池(DAFC)中,將氨電化學轉化為氮氣是實現氮迴圈的重要技術。以前主要用分子複合物催化這種反應,並且需要新增外源性氧化劑或應用比氧還原反應(DAFC的陰極過程)熱力學電位更高的電位。作者在此報告了一種穩定的金屬-金屬鍵合的二釕配合物,它可以在室溫條件下從氨中自發產生氮氣。得到的還原二釕材料可以用氧氣再氧化,用於隨後與氨的反應,證明其能夠自發地促進DAFC所需的兩個半反應。二釕配合物還充當氧化還原介質,用於在-255 mV vs. Fc0/+的電位下將氨電催化氧化為N2,並在鹼性條件下,在氧還原反應電位以下執行,從而實現熱力學可行的DAFC的發展。
背景介紹
零碳燃料技術的發展對社會具有重要意義,解決這個問題的主流框架是“氫經濟”。但由於一些實際限制(例如,生產、儲存、安全性),學術界提出了替代的零碳燃料經濟。其中最引人注目的是“氮經濟”,重點是使用氨作為燃料。由於工業已經實現透過Haber-Bosch工藝大規模生產氨,因此,專門用於大規模分配和儲存氨的基礎設施已經非常完善。此外,在安全性和效率方面,氨在溫和壓力下較低的爆炸危險和優越的可壓縮性,使得其比氫氣更具有優勢。此外,工業界可以透過兩項關鍵技術的持續發展來建立功能性氮/氨經濟:由可再生能源驅動的氮和水合成“綠色”氨,以及氨的高效氧化為燃料電池提供動力。
開發直接氨燃料電池(DAFC)的主要挑戰在於確定氨氧化反應(AOR)的電催化劑。此外,實用的燃料電池需要將陽極的AOR與陰極的氧還原反應(ORR)耦合。對於在DAFC中可行的AOR催化劑,必須滿足兩個要求:對於熱力學可行性,催化劑的操作電位必須低於熱力學ORR電位,而動力學可行性涉及到以有用的反應率克服電阻損失。最近在無機化學領域的大量研究,發現了幾種新的AOR催化劑。然而,在報告電催化的已知系統中,電催化AOR的操作電位要麼超過ORR規定的上限,要麼僅以很小的幅度低於它(<50 mV)。這些系統的缺點可能部分歸因於催化AOR的機制。具體而言,已知的單金屬釕催化劑會導致高度氧化的亞氨基和氮化中間體,這需要高操作電位。
圖文解析
圖1.氮/氨燃料概述和DAFC的催化進展。a,氮/氨經濟的基本組成部分。右圖:從空氣和水中電化學合成氨。左:DAFC。b,基於釕的分子AOR催化劑的操作電位以紅色顯示,本工作的Ru2(chp)4NH3+的操作電位以藍色顯示。
圖2.關鍵的Ru2化合物的合成和結構表徵。a,二釕化合物的合成和反應性,包含了7種複合物。b,複合物2、3、4和7的晶體結構。為簡單起見,省略了所有與碳結合的氫原子。
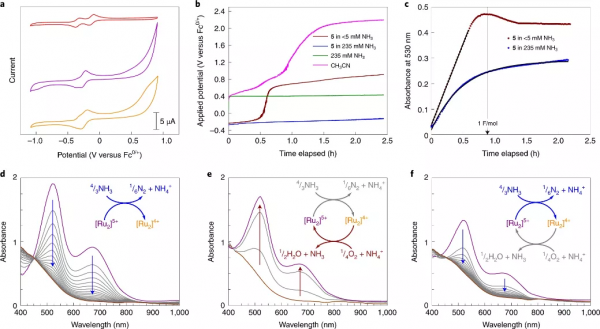
圖3.氨氧化催化的電化學和光譜研究。a,使用玻璃碳圓盤電極和100 mM Bu4NPF6電解質,在CH3CN中以100 mV s-1收集的迴圈伏安曲線圖。從上到下是:複合物2與複合物5'+平衡的迴圈伏安圖(紅色曲線),複合物3由3.2摩爾當量的NH3新增到複合物2(紫色曲線)形成,複合物6由新增10摩爾當量的NH3到複合物5(橙色跡線)形成。b,在CH3CN中控制電流(0.5 mA),用<5 mM(紅色跡線)或235 mM NH3(藍色跡線)電化學氧化複合物5 (0.22 mM) 的曲線。此外,作者還顯示了對照實驗:不含[Ru2]的235 mM NH3(綠色曲線)溶液,以及不含NH3和[Ru2]的溶液(粉紅色曲線)。c,在CH3CN中,使用<5 mM(紅色跡線)或235 mM NH3(藍色跡線)對5號複合物進行受控電流批次電解期間,530 nm 處的吸光度。d-f,電子吸收光譜監測2號複合物 與 100當量NH3的還原(d),隨後與氧氣的再氧化(e),和與額外的100當量NH3的再還原(f)。掃描之間的時間間隔為5分鐘。
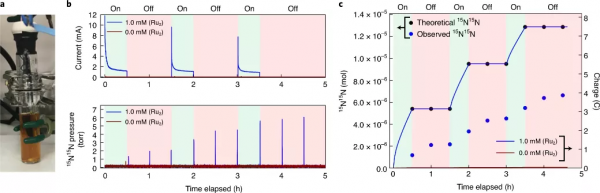
圖4.法拉第效率實驗中使用的裝置和收集的資料。a,法拉第效率實驗中使用的大容量電解池。b,迴圈電解含有Ru2物質、Bu4NPF6電解質和15NH3(藍色跡線)的溶液,以及僅含有Bu4NPF6電解質和15NH3的溶液(紅色跡線)得到的電流曲線(頂部)和m/z = 30 質譜曲線(底部)。c,左軸:Ru2物質與15NH3反應產生的15N15N的理論產率(黑色)和實驗產率(藍色)。右軸:在含有Ru2物質、Bu4NPF6電解質和15NH3(藍色曲線)的溶液以及僅含有Bu4NPF6電解質和15NH3(紅色曲線)的溶液的迴圈電解過程中透過的電荷。
圖5. Ru2複合物電子結構特徵和氨反應機理。a,DFT計算顯示了複合物8中的Ru-Ru-NH2 π* LUMO。b,c,DFT計算的幾何形狀(b)和過渡態TS 1 的表示(c),顯示透過NH3對複合物8的親核攻擊形成N-N鍵。d,所提出的氨電化學氧化催化迴圈。
總結與展望
基於上述結果,作者發現金屬-金屬鍵合的二釕配合物能夠在低過電位下對氨進行電催化氧化,在ORR的熱力學電位之下執行。此外,作者提供了證據,表明二釕AOR催化劑可以透過與分子氧反應再生,這一發現在其他報道的分子AOR催化劑中是沒有的。作者的機理研究表明,金屬-金屬多重鍵能夠形成N-N鍵,而無需獲得單釕系統AOR所需的高能Ru=NH亞胺或Ru ≡ N 氮化物。這一特徵是使[Ru2]4+物質與分子氧輕鬆再氧化的關鍵,為探索具有更低[Ru2]4+/5+電位的新催化劑,作為直接氨燃料電池中的可能成分打開了新的大門,在實現氮經濟方面取得了令人振奮的進展。