調節性 T 細胞(Regulatory T cells,簡稱 Treg)是一類控制體內自身免疫反應性的 T 細胞亞群。它們可以透過表達多種免疫抑制分子、分泌抑制性細胞因子或影響細胞代謝等方式發揮免疫抑制功能,對維持免疫系統穩態具有重要作用。
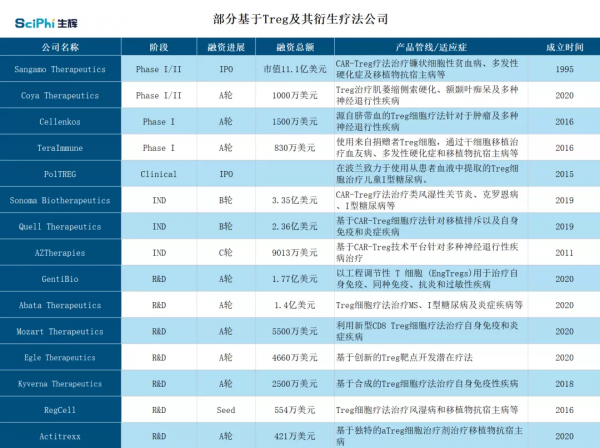
當前階段,基於 Treg 細胞療法和 CAR-Treg 細胞療法已建立起為數不多的疾病研究,其主要市場面向自身免疫疾病和異體移植排斥治療領域。除此之外,由於其在腫瘤免疫中發揮重要作用,Treg 已成為腫瘤免疫治療中最有前途的潛在靶標之一。
據悉,2021 年全球自身免疫性疾病藥物行業市場規模已近 1286 億美元,患病人數約佔全球人口 8%;而 2021 年全球器官移植排斥藥物市場預計約為 50 億美元。
產品尚在蓄勢待發,資本已經察覺到該市場的巨大前景。以 Sonoma Biotherapeutics、GentiBio 和 Abata Therapeutics 三家公司為首,自今年下半年以來已經募集了超過 5 億美元的資金。
“作為體內免疫抑制效益最強大的細胞,理論上 Treg 細胞療法將有助於治療該類疾病”,阿諾醫藥全球研發負責人何南海博士表示,“基於該類患者群體巨大的醫療需求,如果 Treg 細胞療法或 CAR-Treg 細胞療法在臨床上展示出效果和優勢,其將具備巨大的市場潛力。”
維持免疫系統穩態的多面手
機體內的免疫系統是把雙刃劍,一方面,免疫系統透過免疫防禦、監視來清除病原體和體內衰老及癌變的細胞,發揮維持機體健康的作用。另一方面,過度的免疫反應又會引起組織損傷,即發生自身免疫性疾病,甚至造成機體死亡。
可以說,維持免疫系統的穩態平衡作用至關重要,而這一過程正需要依靠 Treg 細胞協助實現。
作為一類具有免疫抑制功能的 T 細胞亞群,Treg 細胞的主要來源包括胸腺來源(tTreg)和外周來源(pTreg)。在 T 細胞發育過程中,接受中間 TCR 訊號的原始 CD4+ T 細胞被驅動分化成 Treg 細胞,訊號強度的大小差異決定了原始 T 細胞分化為常規 T 細胞還是調節性 T 細胞。
從基因水平上看,Treg 細胞的特徵包括 CD4、CD25、FoxP3 和低水平 CD127 的共同表達,其中,FoxP3 是 Treg 細胞的主要調控因子和顯著特徵。此外,不同病理條件將引起 Treg 細胞表型異質性,這使其難以與非抑制性 T 細胞鑑別和純化。
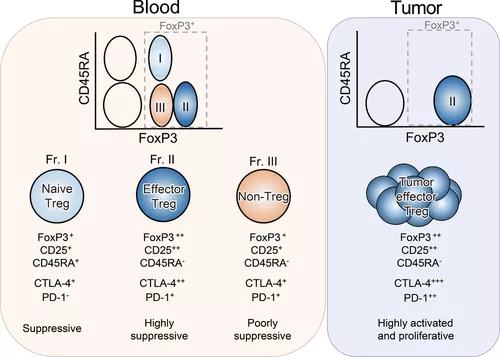
圖丨血液和腫瘤組織中的 FoxP3+ Treg 細胞亞群(來源:European Journal of Immunology)
儘管數量僅佔 CD4+ T 細胞總數的 5-10%,但 Treg 細胞具備多種多樣的免疫調節功能,包括調節自身耐受、腫瘤免疫、抗微生物耐藥性、過敏和移植排斥等。
此前,透過觀察多個病種的臨床表型,研究人員發現,一旦 Treg 細胞的功能和數量出現問題將會導致耐受性喪失和自身免疫性疾病。反之而言,透過促進、啟用或傳遞 Tregs 來恢復免疫穩態和耐受性,或將為治癒或控制自身免疫性疾病指明方向。
在過去的十年中,部分公司已經將目光投向了 Treg 細胞療法,但內源性 Treg 細胞以數量稀少和難以純化的問題構成了重大挑戰。
近年來,Treg 細胞療法經歷了數次技術升級。早期多采用非工程免疫細胞療法,如從患者外周血分離出 Treg 擴增後回輸自體。但是由於所需輸注細胞數量較多,非特異性免疫抑制等風險,Treg 細胞療法仍然受到很大限制。
為解決其應用難題,目前,相關企業主要從兩方面入手。一方面,隨著編輯工具的飛速發展,諸如高親和力 T 細胞受體(TCR)或嵌合抗原受體(CAR)轉導的 Treg 細胞療法正在湧入市場。
不過,顯而易見的是,距離下一代產品進入臨床仍然需要時間。因此,從另一方面,仍有部分公司正在透過改進未經修飾的 Treg 擴增和製造工藝,以便更快地進入市場。
Treg 療法率先進入臨床:分離、擴增、儲存缺一不可
Coya Therapeutics(以下簡稱 Coya)就是這樣一家公司。事實上,由於 Treg 細胞的異質性表型,相關企業需要透過更精確的製造工藝以便分離並獲得高純度產品。
“我們已經完成了關於 Treg 細胞擴增技術的探索工作,” Coya 聯合創始人兼執行長 Howard Berman 介紹,“透過引入生物反應器以實現流程自動化,能夠比現有的細胞分離方法實現更快的擴增和更好的質量控制”。
近年來,Tregs 對於中樞神經系統(CNS)疾病的免疫調節作用已有廣泛報道。已有足夠證據表明,在阿爾茨海默症、肌萎縮側索硬化症(ALS)、中風、帕金森病和多發性硬化症(MS)等相關病理模型中,Tregs 具有抑制小膠質細胞(microglia)活性和減輕神經炎症的能力。
作為專注於神經退行性疾病的生物技術初創企業,Coya 的 Treg 產品建立在由休斯頓衛理公會神經病學研究所聯合主任 Stanley Appel 開發的療法基礎之上,其主打產品專注於減緩 ALS 疾病進展並試圖超越 “力如太” 和 RADICAVA。
2020 年,在與 Stanley Appel 進行會面之後不久,Howard Berman 便辭去了他在艾伯維的職位,並創辦了 Coya,致力於開發 Appel 提出的 Treg 療法。發展至今,Coya 已經與艾伯維、禮來、諾華和 MD Anderson 癌症治療中心先後建立合作。

圖丨 Stanley Appel 博士(來源:Houston Methodist)
對於 ALS 患者而言,該疾病的確診無異於提前宣告了死亡。根據美國國立衛生研究院的統計資料,大多數 ALS 患者將在確診後的三至五年內死於該疾病。目前,雖然有部分緩解症狀的護理方式,但還沒有針對於疾病本身的有效治療手段。
作為國際知名的研究人員和神經病學家,也是美國 ALS 治療進展方面最重要的專家之一。Appel 及其團隊發現,許多 ALS 患者的 Treg 細胞水平較低,或者無法正常工作。因此他們假設,提高 Treg 細胞的數量並恢復功能可能會減緩該疾病的進展。
研究過程中,Appel 記錄了神經退行性病變和 ALS 疾病進展與 Treg 功能障礙和水平降低之間的密切關係,同時提出了分離並 “修復” 患者體內 Treg,並於體外擴充套件後以重新輸注給患者的技術。
該技術成為了 Coya 專有平臺 TAI(Tregs Against Inflammation)的基礎,基於該平臺,Coya 已擴展出不同的療法以滿足 ALS、帕金森、阿爾茨海默症、FTD 和其他自身免疫性疾病患者的醫療需求。
“透過輸注治療,我們將 ALS 疾病進展停止了約一個月。不過,一旦停止輸注,患者體內的 Treg 細胞數量將繼續下降,” Berman 後來補充道,“目前來說,一次性療法無法解決該類患者的問題,我們需要做到持續供貨。”
基於這一問題,Coya 推出了 CTreg 平臺(Tryopreservation for Tregs),這是業內首個用於擴充套件、冷凍和重新解凍 Tregs,並同時保持活力和抑制功能的平臺。用於提供 “現成” 可用的 Treg 細胞療法,以便實現連續性的每月輸注。
據 Berman 介紹,目前 Coya 儲存時間最長的 Treg 細胞已經冷凍了一年半。到目前為止,它們仍然有效。
今年 2 月,Coya 宣佈完成 1000 萬美元的 A 輪融資,以推進研究和管線進展。今年 7 月,Coya 針對於 ALS 的自體 Treg 細胞療法 ALS001,已成功完成了臨床 I 期和 IIa 期試驗,並獲得了 FDA 的孤兒藥資格認定(ODD)。
據 I 期試驗表明,Treg 輸注療法有效阻止了測試的 3 名患者的疾病進展,且沒有不良安全事件。IIa 期試驗資料則重複了 I 期試驗結果,透過每月維持輸注展示出有希望的治療前景,目前正在為同行評審準備相關資料。
據悉,Coya 正在積極籌備進行 IIb 期試驗,以便獲得 FDA 的全面批准。此外,該公司還透露將在年底進行新一輪融資,並表示即將進行 IPO。
自今年 4 月份以來,Coya 接連任命了四名董事會成員,其中包括了百時美施貴寶細胞療法前高階副總裁、諾華製藥神經科學領域的前執行董事和渤健的前生物療法和醫學負責人。
有了這些行業資深人士的幫助,Coya 將更從容地應對來自葛蘭素史克、禮來等製藥巨頭的競爭。今年 7 月,上述公司先後宣佈將針對 ALS 新藥研發開展相關合作和藥物批准申請。
截至目前,全球範圍內共有十餘項臨床試驗針對天然形式的 Tregs 進行了評估。這些試驗中,Tregs 被從患者血液中分離出來,在細胞培養物中生長,然後重新引入患者體內。通常情況下,這種細胞療法看似安全並顯示出了療效。
不過,未經修飾的 Tregs 在其抗原結合庫中變化很大,以至於這些 “多克隆” 細胞通常只有一小部分被啟用並有助於控制疾病。由於效率低下,持續性治療成為常態。因此,最佳化製造平臺和啟用技術是該類公司的必經之路。
除此之外,已經有越來越多的公司正在透過工程化技術,包括 CAR、TCR 和基於 CRISPR 的基因編輯技術作為解決抗原特異性問題的方法。
如何修飾 CAR-Treg?“一切都值得嘗試”
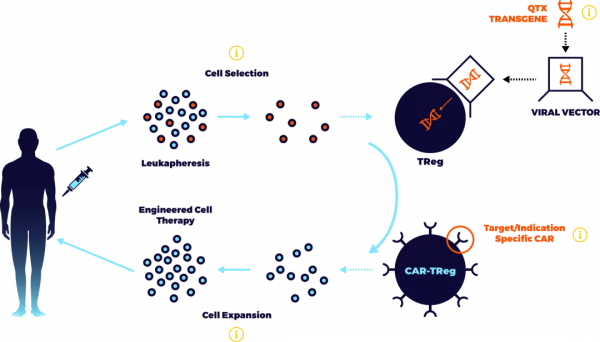
隨著 CAR-T 為代表的工程免疫細胞療法日趨成熟,採用嵌合抗原受體(CAR)來轉導 Treg 細胞的 CAR-Treg 療法開始獲得生物公司的關注。
“相對於 Treg 細胞療法來說,CAR-Treg 技術不僅有助於解決 Treg 細胞在體內不穩定性的問題,同時還能夠根據適應症需要,改善抑制效果,提高靶向性,並克服 MHC 依賴性等問題。極大地推動了 Treg 細胞療法的相關進展。” 何南海解釋道。
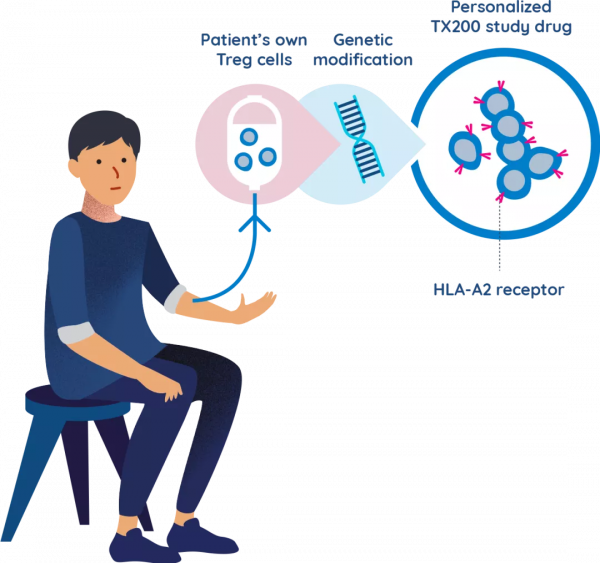
產品方面,Sangamo Therapeutics(以下簡稱 Sangamo)成為了第一個吃螃蟹的人。該公司旗下的 TX200 是第一個進入臨床階段的 CAR-Treg 產品。
該產品源於加拿大不列顛哥倫比亞省兒童醫院研究所免疫學家 Megan Levings 的技術。早在五年前,她和同事們為 Tregs 配備了一種針對人類白細胞抗原 HLA-A2 的嵌合抗原受體。而在研究過程中他們發現,這些 CAR-Treg 細胞有助於防止小鼠模型中的移植排斥。
生物技術公司 TxCell 率先獲得了其技術許可,經過改進後以期進入臨床。2018 年,Sangamo 以 7200 萬歐元現金收購了 TxCell,憑此一躍成為了 CAR-Treg 領域中的佼佼者。
據悉,針對於腎移植患者中進行的 TX200 療法臨床研究已於今年 3 月開始招募。Sangamo 的首席科學官 Jason Fontenot 說,由於此前尚沒有患者接受過工程化的 Tregs,“這裡有很多東西要學”。
除了先行者 Sangamo 之外,其他初創公司,包括 Quell Therapeutics,Kyverna Therapeutics,AZTherapies 和 TeraImmune 等,也正在致力於設計新型的 Treg 產品。
其中,Quell 以倫敦國王學院、倫敦大學學院和漢諾威醫學院的研究為基礎,致力於推出使用多個 FOXP3 複製轉導細胞修飾的 CAR-Treg 產品。
Quell 的執行長 Iain McGill 解釋說,Tregs 是一把雙刃劍。它們可以從抑制表型轉變為攻擊性的效應表型。在最壞的情況下,這種變化不僅會使療效低下,還會導致安全問題,即 CAR-Treg 會破壞它們原本要保護的組織。
為了防止這種情況發生,Quell 的策略在於透過多重基因編輯的方式將 Treg 細胞鎖定為抑制表型。McGill 表示,該方法有效地提高了細胞的穩定性,同時還增加了抑制效果。
透過這一技術,Quell Therapeutics 在 11 月的 B 輪融資中募集了 1.56 億美元。該公司宣稱,如果一切順利,其 CAR-Treg 細胞療法將於明年初進入臨床階段。
需要注意的是,儘管 CAR-T 細胞的快速進展有助於推動 CAR-Treg 技術,不過,該領域的大部分初創公司,無論是使用 TCR 還是 CAR,自然或誘導 Tregs,仍需要不斷最佳化和修改工程化策略。此前, Levings 已經指出:“Tregs 的設計規則與傳統的效應 T 細胞設計不盡相同。”
去年,她和同事在編碼 CD28 或 4-1BB 共受體訊號域的第二代 CAR 的研究中發現了這一點。這兩種設計此前均用於癌症的商業 CAR-T 細胞療法,但只有含有 CD28 CAR 的 Treg 細胞能夠幫助預防小鼠移植物抗宿主病。
對此,加州大學舊金山分校的轉化免疫學家、Sonoma 聯合創始人兼科學顧問 Qizhi Tang 同樣認為,Treg 細胞的最佳設計原則仍需進一步瞭解。“可以透過改造讓 Treg 細胞變得更有效嗎?” 這是一個問題,但她指出,“現階段,一切都值得嘗試。”
目前來說,工程化 Treg 細胞療法仍處於起步階段。第一個利用該技術的臨床候選藥物,來自 Sangamo 的轉基因自體細胞產品 TX200,才剛剛進入人體試驗。大多數其他正在開發的 CAR 或 TCR 重定向的 Treg 療法距離患者使用還有一年或更長時間。
不過,既然是建立於 Treg 細胞之上,CAR-Treg 細胞療法顯然也將面臨分離和純化的難題,依然需要不斷探索更先進的製造方法。