非肌層浸潤性膀胱癌 (NMIBC) 是一種異質性疾病,佔新診斷膀胱癌的75%。經尿道前列腺切除術(TUR)後,高危 NMIBC 患者通常接受卡介苗(BCG)膀胱內灌注治療。目前尚無BCG長期應答、復發或進展為肌層浸潤性膀胱癌(MIBC)的預測因子。近日,一項研究發現,BCG治療之前關鍵驅動基因突變與預後的相關性,並首次提供BCG治療後復發患者體細胞突變譜。
背景和方法
BCG治療之前的臨床病理特徵和腫瘤轉錄組亞型顯示侵襲性生物學特徵,但尚未被證明可作為 BCG應答的預測指標。一項大型研究證明,NMIBC相關驅動基因突變,包括 TERT啟動子突變、染色質修飾基因突變(例如,KDM6A)、原癌基因突變(例如FGFR3和 ERBB2)、ARID1A突變和 CCNE1擴增與 BCG 治療後疾病復發相關,而高腫瘤突變負荷 (TMB) 和 ERCC2 突變與預後較好相關。
同一患者的異時性膀胱癌顯示出不同的基因組突變譜。提示,手術或治療干預會導致腫瘤克隆發生變化,但尚不清楚BCG 治療後的特定基因組突變。為開發基因突變指導的生物標誌物策略,我們必須瞭解臨床相關基因例如FGFR3、ERBB2 和 ERCC2隨治療時間的變異性。
本研究中,研究者對未經BCG治療的NMIBC 和治療後復發的患者進行了深度靶向測序。
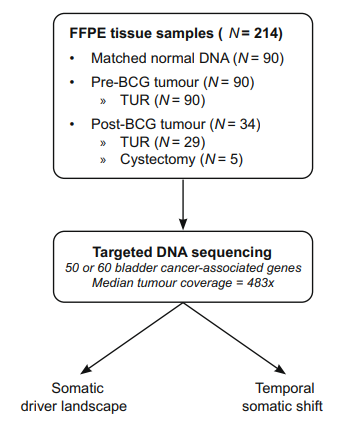
研究者收集開始 BCG 單藥治療時的90 例患者的腫瘤組織,34例BCG初治後NMIBC 患者的腫瘤組織。所有腫瘤組織和配對正常組織都進行了腫瘤靶向測序。
主要結果
高水平TMB與BCG應答相關
表1 患者基線特徵

收集BCG治療之前90例患者腫瘤組織和BCG之後復發或疾病進展的34例患者的腫瘤組織(表1)。對124個腫瘤樣本進行靶向測序(圖1)。
BCG之前中位TMB為8.64mut/Mb,7例患者基線時具有異常高的TMB值,並且在最後一次隨訪時均無復發(7/52應答者vs 0/38出現復發,P=0.02)(圖 2)。結果與既往研究報道一致,即體細胞超突變與BCG應答有相關性。

圖2 BCG應答、復發、進展組中每個BCG治療前樣本的TMB水平條形圖
BCG治療之前的基因突變:ARID1A截斷突變、CCNE1擴增與預後不良相關BCG治療前的驅動基因突變與既往報告中高級別NMIBC一致。FGFR3 啟用熱點突變見於30%腫瘤,並且與 ERBB2 熱點突變(11%)和擴增(21%)不同時出現(P<0.001)。ERBB3、PI3K家族成員(例如PIK3CA基因熱點突變和TSC1截斷突變)相關基因突變也經常出現。
研究者檢測了前20常出現的驅動基因突變與疾病進展的相關性。既往研究顯示,ARID1A截斷突變與預後較差相關,本研究顯示,其與復發時間短相關(圖 3)。CCNE1擴增也與預後不良相關(圖 4),尤其與進展為MIBC相關(進展 HR=5.44,P=0.002)。並且這些預後關係獨立存在。
ERCC2 解旋酶結構域突變很常見 (20%),但與復發風險無關(HR=0.52,P=0.17),即使ERCC2 缺陷腫瘤的 TMB水平更高(23.81 vs 7.73;P< 0.0001)。
BCG治療後相關突變譜的改變
總體上,關鍵驅動基因在BCG治療前和治療後均存在,研究發現有臨床意義相關基因有一定變化。TERT啟動子和染色質修飾基因例如KDM6A突變和ARID1A突變在兩個時間點高度保守(KDM6A: 100% [9/9], TERT: 93% [25/27], ARID1A: 85% [11/13])。
相反,被認為在腫瘤發生後期出現的突變(例如,FGFR3、PIK3CA和TP53突變)在本研究中顯示出了最大的時間變異性。例如,有2例(共6例)患者存在啟用 PIK3CA 螺旋結構域突變,有3例(共5例)患者存在有害TSC1突變,這兩個突變出現在基線時,但BCG治療復發後卻消失不在。
TP53突變與侵襲性癌症相關。在 BCG 治療前檢測到 TP53 突變的16例復發患者中,均保留了TP53 突變狀態。另外,研究發現3例患者經BCG治療後,出現新型體細胞TP53突變,2例患者進展為繼發性 MIBC,第3例患者復發時從 pTa 升期至 pT1。
結論
體細胞超突變、CCNE1和ARID1A突變應納入BCG治療NMIBC的結果預測模型。隨著時間的推移,當考慮靶向治療時,腫瘤基因組學的變化突出了活檢的重要性,並提示,經BCG治療後的復發是由於先前腫瘤細胞持續、不斷地發展。
參考文獻
Jack V.W. Bacon, D.C. Müller, E. Ritch et al., Somatic Features of Response and Relapse in Non–muscle-invasive Bladder Cancer Treated with Bacillus Calmette-Guérin Immunotherapy, Eur Urol Oncol (2021), https://doi.org/10.1016/j.euo.2021.11.002