一年一度的美國血液學會(ASH)年會是全球血液學領域規模最大的國際學術盛會之一,最新突破性研究(LBA,Late-breaking Abstract)是其中最具分量、最為吸睛的版塊。
近日召開的2021年ASH年會上,維博妥珠單抗聯合R-CHP(利妥昔單抗、環磷醯胺、多柔比星、潑尼松)對比R-CHOP(利妥昔單抗、環磷醯胺、多柔比星、長春新鹼、潑尼松)一線治療瀰漫大B細胞淋巴瘤(DLBCL)的Ⅲ期POLARIX研究作為“最新突破研究(LBA-1)”公佈詳細資料,並同步發表於NEJM[1]。
自此,Pola-R-CHP成為近20年來首個在Ⅲ期研究中療效超過R-CHOP的DLBCL治療方案。
重磅!淋巴瘤一線治療20年重大進展
DLBCL是非霍奇金淋巴瘤(NHL)最常見的一種組織學亞型,約佔NHL的30-40%。雖然自R-CHOP方案問世以來療效顯著提高,但多達30%-40%的患者會在一線治療後復發,還有約10%-15%的患者屬於原發性難治[2],此時的挽救性治療選擇有限,患者生存期短。
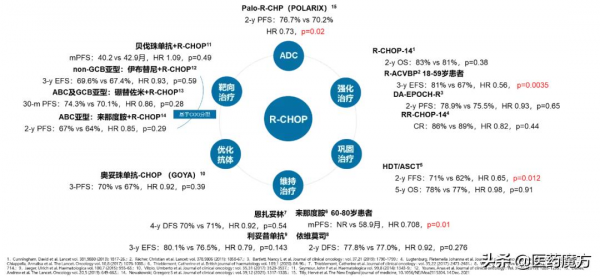
過去二十年來,研究者們發起了若干研究,試圖透過強化治療、鞏固治療、維持治療、最佳化抗CD20抗體、聯合新型靶向藥物等手段提高DLBCL一線治療效果,但絕大多研究並未展示顯著獲益。
圖:DLBCL一線治療重要3期臨床研究及主要終點結果;備註:R-ACVBP和HDT/ASCT鞏固方案雖然達到主要終點,但前者毒性較大,後者未顯示OS獲益且NCCN指南不建議患者常規使用,此外來那度胺維持治療僅在老年患者中顯示EFS獲益且未顯示OS獲益。
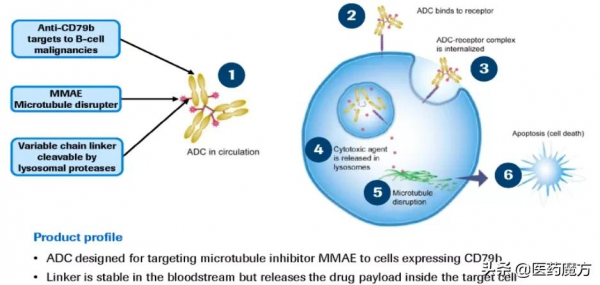
維博妥珠單抗(PolatuzumabVedotin,Pola)是一種靶向CD79b的ADC藥物,可特異性結合B細胞表面CD79b抗原,透過內化和酶切釋放MMAE,後者可結合微管蛋白,抑制其聚合,誘導細胞週期G2/M期停滯和腫瘤細胞凋亡。
來源:羅氏官網
2019年,FDA基於GO29365研究[3]批准其聯合苯達莫司汀和利妥昔單抗(Pola-BR)治療既往接受≥2種方案的復發/難治性瀰漫大B細胞淋巴瘤(R/RDLBCL),Pola成為DLBCL領域全球首個獲批的ADC藥物。在1b/2期研究(NCT01992653)中,Pola-R/G-CHP一線治療DLBCL同樣取得良好療效(ORR:89%,CR:77%)[4]。
POLARIX研究:降低疾病進展或死亡風險達27%
POLARIX研究是一項全球多中心、隨機、雙盲、安慰劑對照的Ⅲ期臨床研究,在全球243家中心開展(包括15箇中國臨床中心),入組既往未治療的DLBCL患者(18-80歲,IPI2-5,ECOG PS 0-2),按照1:1的比例隨機分組接受Pola-R-CHP或R-CHOP +安慰劑(6週期)+利妥昔單抗(2週期)治療。主要終點為研究者評估的無進展生存期(INV-PFS),關鍵次要終點包括無事件生存期(EFS)、完全緩解(CR)、無病生存期(DFS)、總生存期(OS)等。
POLARIX試驗設計(來源:ASH2021)
該研究共入組879名患者,包括160名亞洲患者,中位年齡65(19-80)歲,62%的患者國際預後評分(IPI)3-5分,約1/3的患者為活化B細胞亞型,約45%的患者為雙表達或雙/三打擊淋巴瘤。
POLARIX基線特徵(來源:ASH2021)
研究結果顯示,中位隨訪28.2個月時,Pola-R-CHP組患者的2年PFS率相比R-CHOP組顯著提高(76.7% vs 70.2%),試驗組降低疾病進展或死亡風險達27%(HR 0.73,95%CI:0.57-0.95,p=0.02)。
(來源:N Engl J Med. 2021 Dec14,下同)
關鍵次要終點方面,Pola-R-CHP組相比R-CHOP組患者的2年EFS率顯著提高(75.6% vs 69.4%,HR 0.75,95%CI:0.58-0.96,p=0.02),但2年OS率(88.7% vs 88.6%,HR 0.94,95%CI:0.65-1.37,p=0.75)未觀察到顯著差異。
此外,兩組治療結束時CR率無顯著差異(78%vs 74%,p=0.16),但Pola-R-CHP組DFS更長(HR 0.70,95%CI:0.50-0.98),提示前者可能具有更持續的深度緩解。
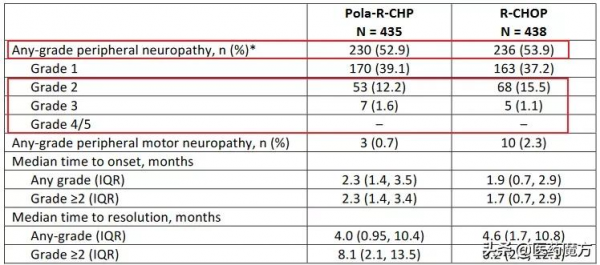
安全性方面,Pola-R-CHP組和R-CHOP組的資料大致相當,未發現預期外的安全訊號,嚴重不良事件發生率分別為34%和30.6%。常見的3-4級AEs(Pola-R-CHP vs R-CHOP)包括:中性粒細胞減少(28.3% vs 30.8%)、發熱性中性粒細胞減少(13.8% vs 8.0%)和貧血(12.0% vs 8.4%)。兩組周圍神經病變發生頻率及程度無顯著差異。
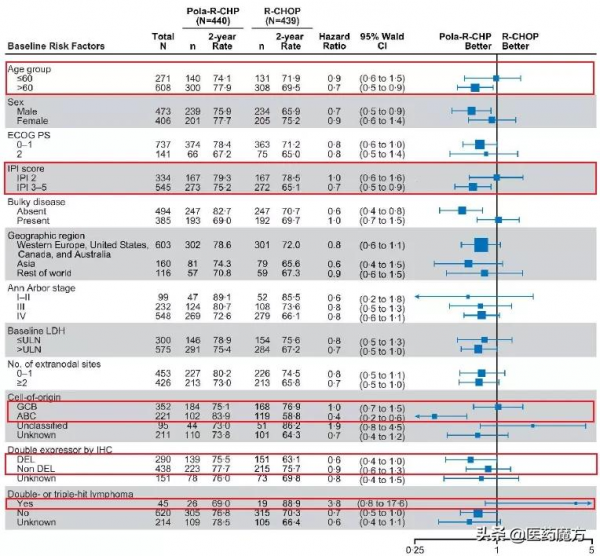
亞組分析顯示,在年齡>60歲、IPI3-5分、活化B細胞亞型(ABC)亞型患者中Pola-R-CHP組可見PFS獲益,但在≤60歲、IPI 2分、伴大包塊疾病(bulkydisease)和GCB亞型的患者中兩組PFS無顯著差異,而對於雙/三打擊淋巴瘤患者R-CHOP方案的PFS數值更優。
綜上所示,POLARIX研究證實,Pola-R-CHP方案相比R-CHOP顯著改善了初治DLBCL患者的PFS,成功突破了DLBCL一線治療的“天花板”。然而,考慮到OS易受後線治療影響,而R-CHOP組患者後線接受移植及CAR-T治療的比例高於Pola-R-CHP組,尚需耐心等待更長隨訪時間的證據更新。
What’s more:DLBCL一線精準治療,路在何方?
眾所周知,瀰漫性大B細胞淋巴瘤(DLBCL)是起源於B淋巴細胞的一類存在較大異質性的惡性腫瘤。理想化的狀態是每位患者可以進行基因分型,依據基因分型給予的精準治療。
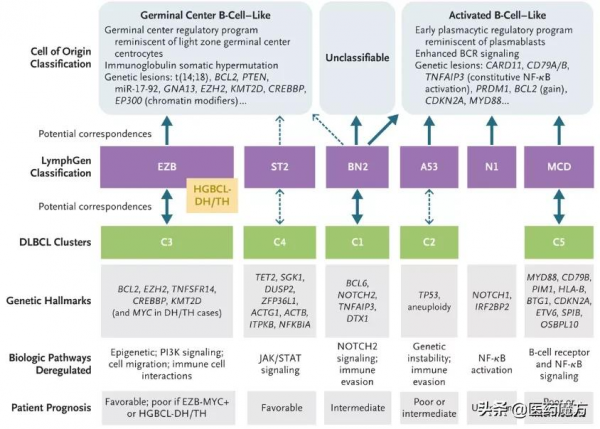
儘管基於DLBCL細胞起源(COO)分型的三項Ⅲ期研究(PHOENIX:伊布替尼+R-CHOP,REMoDL-B:硼替佐米+R-CHOP,ROBUST:來那度胺+R-CHOP)均未達到終點,但隨著對DLBCL異質性瞭解的加深,尤其是Shipp教授和Staudt教授基於測序技術分別提出的DLBCL Cluster[5]和LymphGen分型[6],為更精準的患者選擇及靶向治療提供了依據。
PHOENIX研究事後分析顯示,<60歲的MCD及N1亞型患者經伊布替尼+R-CHOP治療後3年EFS及OS可達100%,顯著高於對照組[7]。今年7月世界淋巴瘤大會(ICML)上,上海瑞金醫院趙維蒞教授也報告了2期Guidance-01研究中”基於分子分型的R-CHOP+X方案”一線治療DLBCL療效顯著優於R-CHOP方案(CR 87% vs 66%,p=0.003)。
COO、DLBCL Cluster、LymphGen分型及其關(來源:N Engl JMed. 2021;384(9))
此次,本次ASH大會上CAR-T細胞療法阿基侖賽(ZUMA-12,摘要#739),多藥聯合方案澤布替尼+來那度胺+R-CHOP(摘要#3559),anti-CD20/CD3雙抗epcoritamab聯合R-CHOP(摘要#1413)、anti-CD19單抗Tafasitamab±來那度胺聯合R-CHOP(摘要#3556)也在2期研究中展現了針對初治DLBCL人群的良好療效。
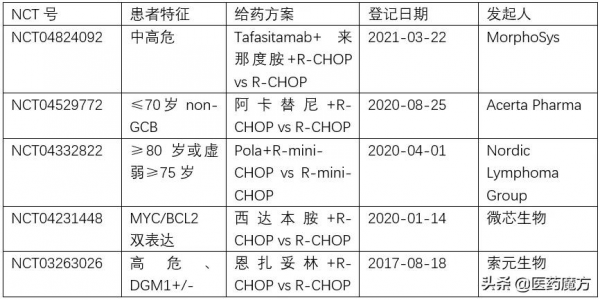
目前,多項DLBCL一線治療的Ⅲ期研究正在進行之中,期待未來更多循證結果能夠探索出依據基因分型的DLBCL一線治療方案選擇。
表:正在進行的DLBCL一線治療Ⅲ期研究(來源:Clinicaltrials)
參考資料:
[1] Tilly, Hervé et al. “Polatuzumab Vedotin in Previously UntreatedDiffuse Large B-Cell Lymphoma.” The New England journal of medicine,10.1056/NEJMoa2115304. 14 Dec. 2021, doi:10.1056/NEJMoa2115304
[2] Sehn, L. H., & Salles, G. (2021). Diffuse Large B-CellLymphoma. The New England journal of medicine, 384(9), 842–858.https://doi.org/10.1056/NEJMra2027612
[3] Sehn, Laurie H et al. “Polatuzumab Vedotin in Relapsed orRefractory Diffuse Large B-Cell Lymphoma.” Journal of clinical oncology :official journal of the American Society of Clinical Oncology vol. 38,2 (2020):155-165. doi:10.1200/JCO.19.00172
[4] Tilly, Hervé et al. “Polatuzumab vedotin in combination with immunochemotherapyin patients with previously untreated diffuse large B-cell lymphoma: anopen-label, non-randomised, phase 1b-2 study.” The Lancet. Oncology vol. 20,7(2019): 998-1010. doi:10.1016/S1470-2045(19)30091-9
[5] Chapuy, B., Stewart, C., Dunford, A. J., Kim, J., Kamburov, A.,Redd, R. A., Lawrence, M. S., Roemer, M., Li, A. J., Ziepert, M., Staiger, A.M., Wala, J. A., Ducar, M. D., Leshchiner, I., Rheinbay, E., Taylor-Weiner, A.,Coughlin, C. A., Hess, J. M., Pedamallu, C. S., Livitz, D., … Shipp, M. A.(2018). Molecular subtypes of diffuse large B cell lymphoma are associated withdistinct pathogenic mechanisms and outcomes. Nature medicine, 24(5), 679–690.https://doi.org/10.1038/s41591-018-0016-8
[6] Wright, G. W., Huang, D. W., Phelan, J. D., Coulibaly, Z. A.,Roulland, S., Young, R. M., Wang, J. Q., Schmitz, R., Morin, R. D., Tang, J.,Jiang, A., Bagaev, A., Plotnikova, O., Kotlov, N., Johnson, C. A., Wilson, W.H., Scott, D. W., & Staudt, L. M. (2020). A Probabilistic ClassificationTool for Genetic Subtypes of Diffuse Large B Cell Lymphoma with TherapeuticImplications. Cancer cell, 37(4), 551–568.e14.https://doi.org/10.1016/j.ccell.2020.03.015
[7] Wilson, Wyndham H et al. “Effect of ibrutinib with R-CHOPchemotherapy in genetic subtypes of DLBCL.” Cancer cell vol. 39,12 (2021):1643-1653.e3. doi:10.1016/j.ccell.2021.10.006