Trodelvy已在美國上市,是第一個顯著延長TNBC患者總生存期(OS)的藥物。在中國,Trodelvy上市申請已獲國家藥監局受理。
吉利德科學(Gilead Sciences)近日在2020年歐洲醫學腫瘤學會(ESMO)虛擬大會上公佈了抗體偶聯藥物(ADC)Trodelvy(sacituzumab govitecan-hziy,戈沙妥組單抗)治療三陰性乳腺癌(TNBC)3期ASCENT研究(NCT02574455)的新資料。ASCENT是一項國際性、開放標籤3期研究,共入組了500多例復發或難治性轉移性TNBC患者,這些患者先前接受過至少2種療法治療、至少1種用於治療轉移性疾病。研究中,患者被隨機分為2組,一組接受Trodelvy,另一組接受醫生選擇的化療。
此次會議上公佈的一項回顧性亞組分析顯示:在最初未診斷為TNBC的患者中,與化療相比,Trodelvy改善了無進展生存期(PFS)、總生存期(OS)、客觀緩解率(ORR)。在乳腺癌轉移階段,患者從一種亞型轉變為另一種亞型並不罕見。在ASCENT研究中,大約三分之一的TNBC患者最初沒有被診斷為TNBC,與化療相比,Trodelvy對這些患者有生存益處。對於治療醫生來說,這些資料加強了Trodelvy對更復雜患者的療效。
會上公佈的這項分析,包括了146名符合化療條件的腦轉移陰性患者,其最初診斷為非TNBC乳腺癌,其中70名接受Trodelvy治療,76名接受醫生選擇的化療。在這些患者中,與化療相比,Trodelvy改善了中位PFS(4.6個月 vs 2.3個月;HR:0.48;P=0.0004)、中位OS(12.4個月 vs 6.7個月;HR:0.44;P<0.0001)、ORR(31% vs 4%)相比,Trodelvy改善了中位PFS。該亞組結果與總體ASCENT研究人群的結果相似。
該亞組中,Trodelvy的安全性與先前的ASCENT研究報告一致。Trodelvy與化療相比,關鍵治療相關≥3級不良事件為:中性粒細胞減少(59% vs 40%)、白細胞減少(12% vs 9%)、貧血(8% vs 7%)和腹瀉(7% vs 0%)。Trodelvy沒有治療相關死亡。Trodelvy美國處方資訊附有關於嚴重或危及生命的中性粒細胞減少症和嚴重腹瀉的黑框警告。
吉利德腫瘤臨床研究高階副總裁Bill Grossman博士表示:“Trodelvy已經在改變二線或晚期轉移性TNBC患者的預後。我們致力於持續研究,進一步確定Trodelvy的臨床特徵。因此,我們很高興對最初未診斷為TNBC的患者進行的這項亞分析顯示:總生存期、無進展生存期、緩解率與在總體ASCENT研究人群中觀察到的相似。”
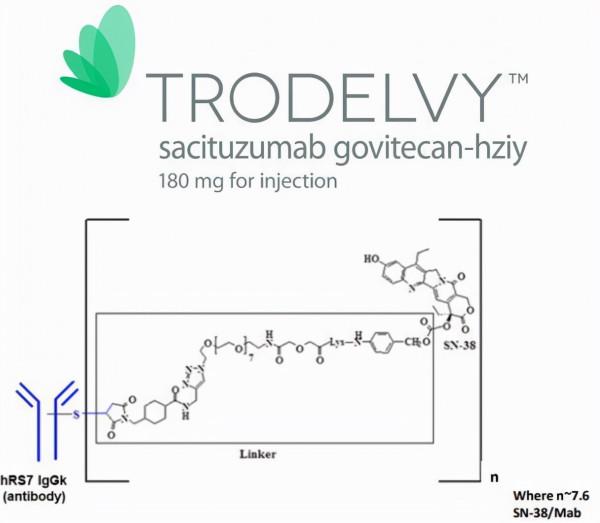
Trodelvy結構特徵(圖片來源:broadpharm.com)
Trodelvy(戈沙妥組單抗)由Immunomedics公司開發,其專有ADC平臺的核心是使用一種新型的連結子,這種連結子不需要酶來釋放有效荷載,可在腫瘤細胞內和腫瘤微環境中遞送活性藥物,從而產生近旁效應(bystander effect)。2019年4月,雲頂新耀(Everest Medicines)與Immunomedics簽訂協議,獲得了Trodelvy在大中華區、韓國、蒙古國、東南亞國家和地區的權益。2020年9月,吉利德以210億美元收購Immunomedics,將Trodelvy收入囊中。
目前,Trodelvy已在美國上市。在中國,2020年10月,Trodelvy(戈沙妥組單抗)被納入到2020版《中國晚期乳腺癌規範診療指南》,該指南由國家腫瘤質控中心乳腺癌專家委員會、中國抗癌協會乳腺癌專業委員會、中國抗癌協會腫瘤藥物臨床研究專業委員會共同編撰。2021年5月,國家藥監局(NMPA)受理了Trodelvy的生物製品上市許可申請。
值得一提的是,Trodelvy是第一個可提高轉移性TNBC患者無進展生存期(PFS)和總生存期(OS)的療法,標誌著TNBC治療方面的一個重大進步。在3期ASCENT研究中,與化療相比,Trodelvy將PFS顯著延長(中位PFS:4.8個月 vs 1.7個月、疾病進展或死亡風險顯著降低57%(HR=0.43,p<0.0001)、將OS顯著延長(中位OS:11.8個月 vs 6.9個月)、死亡風險顯著降低49%(HR=0.51,p<0.0001)、顯著提高總緩解率(ORR:35% vs 5%)。
三陰性乳腺癌(TNBC)是一種高度侵襲性疾病,約佔全球所有乳腺癌型別的15%。在亞洲,乳腺癌的確診年齡中位數與西方國家相比有年輕化趨勢,近10年來,TNBC分子亞型的比例逐步上升。TNBC腫瘤缺乏足夠的雌激素、孕激素或HER2受體表達,內分泌療法或HER2靶向治療基本無效。在過去20多年中,TNBC患者的總生存期一直沒有改善,亟待開發新的有效治療方案。
Trodelvy是一款靶向Trop-2的新型、首創的抗體偶聯藥物(ADC),由靶向TROP-2抗原的人源化IgG1抗體與化療藥物伊立替康(一種拓撲異構酶I抑制劑)的代謝活性產物SN-38偶聯而成,藥物-抗體比高達7.6:1。Trop-2是一種在許多上皮性腫瘤中頻繁表達的細胞表面蛋白,包括轉移性三陰性乳腺癌(mTNBC)和轉移性尿路上皮癌(mUC),其高表達與高複發率和低生存率相關。Trodelvy與Trop-2靶向結合並遞送抗癌製劑SN-38來殺死癌細胞。
Trodelvy於2020年4月獲得了美國FDA加速批准,並於2021年4月獲得了完全批准,用於治療:先前已接受過至少2種療法、其中至少1種療法治療轉移性疾病的不可切除性區域性晚期或轉移性TNBC成人患者。
2021年4月,Trodelvy再獲美國FDA批准一個新的適應症,用於治療:先前接受過含鉑化療、還接受過一種PD-1抑制劑或一種PD-L1抑制劑治療的區域性晚期或轉移性尿路上皮癌(UC)成人患者。
目前,Trodelvy的一份新適應症申請也正在接受美國FDA的審查:用於治療先前在新輔助/輔助、轉移性疾病中已接受過含鉑化療和PD-1抑制劑或PD-L1抑制劑治療的區域性晚期或轉移性尿路上皮癌(UC)成人患者。
Trodelvy也被開發用於治療HR+/HER2-轉移性乳腺癌和轉移性非小細胞肺癌(NSCLC),對多種實體瘤的額外評估也在進行中。