【能源人都在看,點選右上角加'關注'】
孫 娟1, 王 寧1, 陳宏坤2,3, 宋權威2,3, 楊曉晴1, 趙朝成1, 張秀霞1, 鄭秀志1
(1.中國石油大學(華東) 化學工程學院,;2.石油石化汙染物控制與處理國家重點實驗室,3.中國石油集團安全環保技術研究院有限公司,)
摘要
採用高通量測序法研究東營某煉油廠不同汙染程度的土壤中細菌、真菌和古菌的群落結構,分析石油汙染對土壤微生物群落結構的影響。結果表明:微生物群落可操作分類單元(OTU)數量隨著油汙土壤油含量的增加先增多後減少;Beta多樣性與土壤石油汙染程度有一定的關係;受汙染程度相近的土壤樣品,微生物群落結構的相似度較高。細菌、真菌、古菌群落中相對丰度最大的分別為變形菌門(Proteobacteria)、子囊菌門(Ascomycota)和奇古菌門(Thaumarchaeota),分別為44.8%~79.5%、54.4%~83.2%和28.3%~93.1%。屬水平群落聚類分析結果顯示,隨著土壤油含量增加,真菌踝節菌屬(Talaromyces)的相對丰度由0增加到31.6%,細菌寡養單胞菌(Stenotrophomonas)由0.1%增加到1.9%,古菌甲烷八疊球菌屬(Methanosarcina)由5.8%增加到37.8%。微生物群落結構與土壤中烴類組分含量相關性分析發現,真菌炭疽菌屬(Colletotrichum)、細菌節桿菌屬(Arthrobacter)、古菌鹽紅菌屬(Halorubrum)與烷烴含量呈顯著正相關性,細菌甲基桿菌屬(Methylobacterium)、古菌甲烷八疊球菌屬(Methanosarcina)與芳香烴含量呈顯著正相關性。
關 鍵 詞: 油汙土壤;微生物群落結構;高通量測序;生物修復
石油是一種重要的能源,在促進經濟發展的同時也帶來了大量的環境問題。在石油開採、儲運和生產加工等過程中,不可避免地會對土壤、地表水及地下水造成不同程度的汙染。其中,在油田和油井鑽鑿過程中對周圍土壤的汙染、石油開採過程中形成的落地油、輸油管路的滲漏等,是土壤石油汙染的主要途徑[1]。石油汙染物可以影響土壤的微生物群落結構[2-10]。微生物與環境的相互作用是微生物在各種不同環境中生存和繁殖的關鍵。其中,土壤細菌群落是土壤微生物中數目最多、分佈最廣且成分最豐富的微生物之一,土壤真菌是土壤微生物的主要成員,古菌是土壤中存在的一種特殊的生命形式。它們共同作為土壤生態系統的重要組成部分,在碳迴圈、氮迴圈等生物地球化學程序中起著不可替代的作用。同時,土壤的理化性質和生物學特徵也被土壤微生物透過不同途徑改變,包括有機質的合成分解、汙染物降解、養分固定與釋放等[11-17]。
目前,對土壤微生物群落結構的研究可採用變性梯度凝膠電泳、實時熒光定量PCR、熒光原位雜交、序列標籤標記的高通量測序以及宏基因組等技術。其中,高通量測序技術具有高準確度、低成本等優勢[18-19]。因此,筆者採用高通量測序技術對不同汙染程度的石油汙染土壤樣品中細菌、真菌以及古菌群落結構進行研究,探究微生物群落分佈及其與石油汙染土壤性質之間的關係,為深入認識油汙土壤微生物群落分佈特徵以及油汙土壤的高效生物修復技術的建立提供理論基礎。
1 實驗部分
1.1 原料和試劑
實驗試劑:牛肉浸膏、胰蛋白腖、瓊脂粉,BR,國藥集團化學試劑有限公司產品;氯化鈉、無水硫酸鈉、四氯化碳、碳酸氫鈉、正己烷,AR,上海泰坦科技股份有限公司產品;矽酸鎂、氯化鉀、重鉻酸鉀、濃硫酸、鄰菲羅啉、硫酸亞鐵、鉬銻抗、硼酸、甲基紅、溴甲酚綠、濃鹽酸、高錳酸鉀、矽膠,AR,國藥集團化學試劑有限公司產品;二氯甲烷、氫氧化鈉,AR,西隴科學股份有限公司產品。
油汙土壤樣品:油汙土壤採集地點位於東營某煉油廠(東經118°5′,北緯38°15′)的油罐區(YGQ)、汙油場(WYC)、垃圾場(LJC)3個地點,各採集 0~20 cm 上層土壤樣品和20~50 cm下層土壤樣品,分別記為YGQ0-20、YGQ20-50、WYC0-20、WYC20-50、LJC0-20、LJC20-50。將各土壤樣品去除植物根系和石塊後經2 mm尼龍篩過篩,備用。
1.2 土壤性質測定方法
採集的新鮮土壤樣品立即採用烘乾法進行含水率的測定,並採用平板計數法測量細菌總數。土壤樣品風乾後進行其他性質的測定。其中,採用篩分法測定土壤粒徑,採用酸度計法測定土壤pH值,採用電導率儀測定土壤電導率,採用重鉻酸鉀容量法測定土壤有機質含量,採用凱氏定氮法測定土壤全氮含量,採用碳酸氫鈉浸提-鉬銻抗分光光度法(TU-1901雙光束紫外可見分光光度計)測定土壤有效磷含量,採用四氯化碳萃取-紅外分光光度法(紅外光度測油儀2000-Ⅰ,吉林歐伊爾環保科技發展有限公司產品)測定土壤油含量,採用比重瓶法測定土壤密度。對於測定的土壤性質均進行3次測定取平均值。
1.3 油汙土壤烴類組分分析方法
油汙土壤樣品用二氯甲烷萃取後脫水、濃縮後過層析柱,飽和烴和芳香烴洗出液均濃縮到0.9 mL,分別加入100 μL正構烷烴內標(C24D50,100 μg/mL)和100 μL多環芳烴內標(d14-三聯苯,20 μg/mL),定容後採用安捷倫科技有限公司生產的7890A-5975C GC-ms聯用儀(配備MS5975型質譜檢測器和30 m×0.25 mm×0.25 μm的HP-5ms毛細管色譜柱)測定萃取液中烴類組分,並計算油汙土壤中烴類組分的質量分數。
色譜條件:高純N2為載氣,流速為1.0 mL/min;進樣口溫度為280 ℃;進樣方式為不分流;升溫程式為初始溫度50 ℃保持5 min,以升溫速率 6 ℃/min 升溫至300 ℃並保持20 min。
質譜條件:電子轟擊電離源,離子源溫度280 ℃,採用全掃描(SCAN) 模式。土壤樣品中烴類組分含量(質量分數)計算方法如式(1)~(3)所示[20]。
(1)
(2)
(3)
式中: FRR(Relative response factor)為相對響應因子;AC0和 AC1為標準樣品和所測樣品中組分峰面積;AI0和AI1為標準樣品和所測樣品中內標峰面積;mC0和 mC1為標準樣品和所測樣品中組分質量,g;mI0和 mI1為標準樣品和所測樣品中內標質量,g;n為稀釋倍數;V1為所測樣品體積,mL;V2為油汙土壤萃取液總體積,mL;mT為土壤的質量,g;wT為土壤中組分質量分數,g/g。
1.4 高通量測序及統計分析
將採集的新鮮土壤樣品進行脫氧核糖核酸(DNA)提取和高通量測序。採用分光光度計(Nanodrop)進行紫外定量檢測總DNA,採用Q5高保真DNA聚合酶進行聚合酶鏈式反應(PCR)擴增。PCR擴增產物透過2%瓊脂糖凝膠電泳進行檢測,並採用AXYGEN公司生產的凝膠回收試劑盒對目標片段進行切膠回收。參照電泳初步定量結果,將PCR擴增回收產物進行熒光定量。根據熒光定量結果,按照每個樣品的測序量需求,對各樣品按相應比例進行混合。最後,採用Illumina MiSeq平臺對土壤樣品真菌、細菌、古菌群落DNA片段進行雙端測序。使用QIIME軟體,呼叫UCLUST這一序列比對工具,對前述獲得的序列按照97%的序列相似度進行歸併和可操作分類單元(Operational taxonomic unit,OTU)劃分,並選取每個OTU中丰度最高的序列作為該OTU的代表序列。使用QIIME軟體,獲取各樣品在門、綱、目、科、屬5個分類水平上的組成和豐度分佈表。透過主成分分析研究樣品Beta多樣性,對群落資料結構進行自然分解並透過對樣品排序,觀測樣品之間的差異。
採用Chao1豐富度指數、ACE豐富度指數、Shannon多樣性指數和Simpson多樣性指數來反映其Alpha多樣性,使用QIIME軟體分別對每個樣品計算上述4種多樣性指數。使用R軟體,對丰度前50位的屬進行聚類分析並繪製熱圖。分析油汙土壤微生物群落與土壤烴類組分的相關性,將各樣品群落按照門及屬水平分別進行整理,分析群落組成受石油汙染的影響。
2 結果與討論
2.1 油汙土壤基本性質
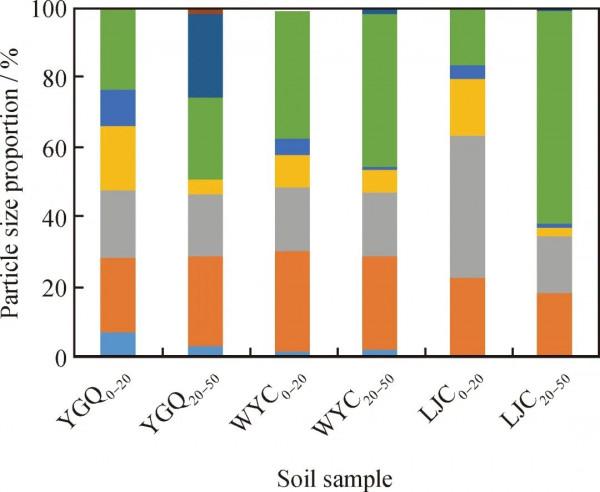
圖1為油汙土壤樣品的粒徑分佈。根據土壤的分類和定名標準[21],YGQ0-20、YGQ20-50、WYC0-20、WYC20-50、LJC0-20為粗砂,LJC20-50為中砂。表1為油汙土壤的基本性質。由表1可以看出,YGQ0-20土壤樣品含水率最低,僅為1.35%(質量分數),其次為WYC0-20,含水率為14.25%,其餘土壤樣品含水率均在20%以上。從土壤pH值可以看出,LJC0-20和LJC20-50為弱鹼性土壤,其餘樣品為中性土壤,油汙程度對pH值沒有明顯的影響。WYC0-20土壤樣品中油質量分數最高為8.632 g/kg,其次為LJC0-20;YGQ取樣點油含量明顯低於WYC、LJC兩點,YGQ20-50油含量最低;油汙土壤樣品的油含量與有機質含量呈正比關係。土壤有效磷質量分數為0.6~14.0 mg/kg,全氮質量分數為9~79 mg/kg,且油含量與有效磷含量和全氮含量無明顯的相關性。
2-0.9 mm;
0.9-0.6 mm;
0.6-0.5 mm;
0.5-0.45 mm;
0.45-0.1 mm;
0.1-0.08 mm;
≤0.075 mm
圖1 油汙土壤樣品粒徑分佈
Fig.1 Particle size distributions of oil-contaminated soil samples 表1 油汙土壤基本性質
Table 1 Properties of oil-contaminated soil samples
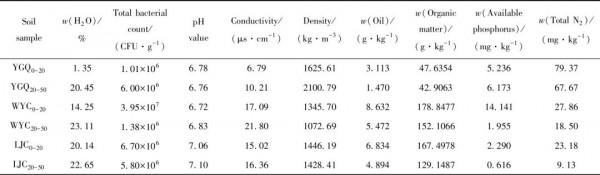
油汙土壤中烴類組分含量如圖2所示。YGQ取樣點正構烷烴含量明顯低於WYC、LJC兩點,烷烴質量分數均低於2.5 μg/g,碳數範圍分佈在C16~C31,但芳烴質量分數較高,最高達到2.0 μg/g。YGQ取樣點C10~C15範圍的正構烷烴含量較低,YGQ0-20中C18~C21範圍的正構烷烴含量高於YGQ20-50,YGQ20-50中C22~C28範圍的正構烷烴含量相對較高。YGQ0-20中芳香烴的種類和含量遠大於YGQ20-50,相對含量較高的有萘、菲、芴、蒽和芘,苯、二苯並噻吩和
含量較低。YGQ20-50中含有少量的苯、菲、
、蒽和芘。WYC取樣點C9~C15範圍的正構烷烴含量較低,WYC0-20中C16~C21範圍的正構烷烴含量明顯高於WYC20-50。WYC0-20中芳香烴含量高、種類多,主要為苯、萘、菲、二苯並噻吩、芴、
、蒽和芘,其中,菲和芘的含量較高。WYC20-50中碳數範圍在C22~C32的正構烷烴含量較高,芳香烴質量分數均低於0.50 μg/g,含有菲、
和芘以及少量的萘和蒽。相比YGQ、WYC兩點,LJC取樣點烷烴質量分數最高(最高超過10 μg/g),但芳香烴質量分數最低(均低於0.32 μg/g)。LJC0-20中正構烷烴碳數範圍在C13~C24之間含量較高,且LJC0-20中芳香烴含量也明顯高於LJC20-50,苯、萘、菲、
和芘含量較高。LJC20-50中碳數範圍在C25~C30的正構烷烴含量較高,芳香烴以少量菲、
、芘為主。
F1—Normal paraffin; F2—Aromatic hydrocarbons
A—Anthracene; B—Benzene; C—Chrysene; D—Dibenzothiophene; F—Fluorene; N—Naphthalene; P—Phenanthrene; I—Pyrene
圖2 油汙土壤中烴類組分含量分佈
Fig.2 Hydrocarbons mass fraction in oil-contaminated soil samples
(a) YGQ-F1; (b) YGQ-F2; (c) WYC-F1; (d) WYC-F2; (e) LJC-F1; (f) LJC-F2
綜上所述,可以認為油汙土壤中正構烷烴碳數範圍主要分佈在C13~C32,同一取樣點上層土壤中碳數範圍在C16~C21的正構烷烴含量較高,而下層土壤中C22~C30的正構烷烴含量較高。上層土壤中芳香烴的種類和含量明顯高於下層土壤。
2.2 油汙土壤中微生物群落多樣性指數分析
2.2.1 油汙土壤的微生物群落豐富度及多樣性
6個土壤樣品透過質量篩查,且Index完全匹配時共獲得272199條有效ITS序列、227067條有效細菌序列、210468條有效古菌序列。將以97%的序列相似度作為OTU劃分和分類地位鑑定,此次測序結果可劃分為845個真菌OTU、5444個細菌OTU及451個古菌OTU(分類至屬水平)。圖3為不同油含量的油汙土壤中微生物群落的OTU數量。從圖3可以看出,微生物群落OTU數量隨著油汙土壤油含量增加呈先增加後減少的趨勢,這說明石油為微生物的生長提供了豐富的碳源,但當土壤中油質量分數(即汙染程度)高於8.632 g/kg時,則會抑制微生物生長。
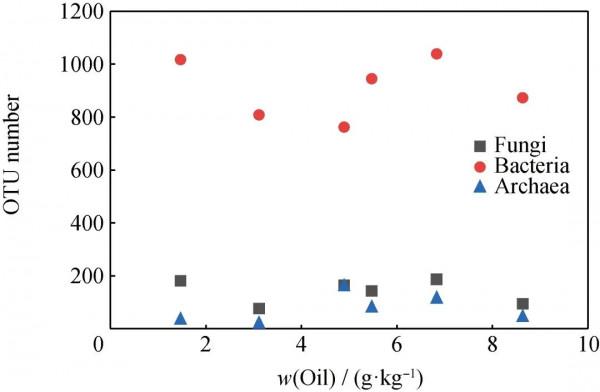
圖3 不同油含量的油汙土壤中微生物群落的可操作分類單元(OTU)數量
Fig.3 Operational taxonomic unit (OTU) number of the microbial communities in the oil-contaminated
soil samples with different oil contents
對於微生物群落而言,有多種指數來反映其Alpha多樣性。常用的度量指數主要包括側重於體現群落豐富度的Chao1指數和ACE指數,以及兼顧群落均勻度的Shannon指數和Simpson指數。一般而言,Chao1或ACE指數越大,表明微生物群落的豐富度越高;Simpson指數降低,表明微生物群落的多樣性降低,Shannon指數越高,表明微生物群落的均一性越高。表2為不同油汙土壤樣品的真菌、細菌、古菌群落的多樣性指數。根據Chao1或ACE指數可知,油汙土壤樣品真菌群落的豐富度由大到小順序為LJC0-20、YGQ20-50、 LJC20-50、WYC20-50、 WYC0-20、YGQ0-20;其細菌群落的豐富度由大到小順序為YGQ20-50、 LJC20-50、 WYC20-50、WYC0-20、LJC0-20、YGQ0-20;其古菌群落的豐富度由大到小順序為LJC0-20、LJC20-50、WYC20-50、YGQ20-50、WYC0-20、YGQ0-20。根據Shannon和Simpson指數可得,油汙土壤樣品真菌群落的多樣性由大到小順序為LJC20-50、YGQ20-50、LJC0-20、WYC20-50、WYC0-20、YGQ0-20;其細菌群落的多樣性由大到小順序為YGQ20-50、LJC0-20、LJC20-50、WYC20-50、WYC0-20、YGQ0-20;其古菌群落的多樣性由大到小順序為LJC0-20、WYC20-50、LJC20-50、YGQ20-50、YGQ0-20、WYC0-20。可以看出:YGQ0-20和WYC0-20樣品群落的豐富度和多樣性均較差;這可能是因為YGQ0-20含水率過低(質量分數1.35%),影響了微生物群落的豐富度和多樣性;WYC0-20土壤樣品中油質量分數過高(8.632 g/kg),抑制了微生物生長,從而影響了其豐富度和多樣性。
2.2.2 油汙土壤的Beta多樣性分析
使用R軟體對加權(Weighted)的UniFrac距離矩陣進行非度量多維尺度分析(NMDS),透過二維排序圖描述群落樣品的結構分佈(結果如圖4所示),每個點代表1個樣本,不同顏色的點屬於不同樣本(組),2點之間的距離越近,表明2個樣本之間的微生物群落結構相似度越高,差異越小。從圖4(a)可以看出,對於真菌群落,WYC和LJC取樣點分佈較為分散,而YGQ0-20和YGQ20-50距離較近,表明兩者的群落構成差異較小。從圖4(b)可以看出:對於細菌群落,油含量最低的YGQ20-50距離其他取樣點較遠,群落構成的差異也較大;而WYC0-20、WYC20-50、LJC0-20和LJC20-50油含量相近,群落相似性也較高。由圖4(c) 可以看出,對於古菌群落,油含量最低的YGQ20-50和最高的WYC0-20距離較遠,群落結構差異性也較大。由此可以認為,油汙土壤中微生物群落的Beta多樣性與其受石油汙染程度有一定的關係,油含量相近的油汙土壤樣品,其微生物群落結構的相似度較高。Natsuko等[22]釆集美國不同油汙地區的土壤進行微生物群落結構調查,發現油含量相近的土壤微生物種群差異不大。賈建麗等[23]分別採集中國不同地區的5個油田的油汙土壤,研究微生物群落結構,也得出了相似的結果。
表2 不同油汙土壤樣品真菌、細菌、古菌群落的多樣性指數
Table 2 Diversity index of fungi, bacteria, archaea community in different oil-contaminated soil samples

OTU—Operational taxonomic unit
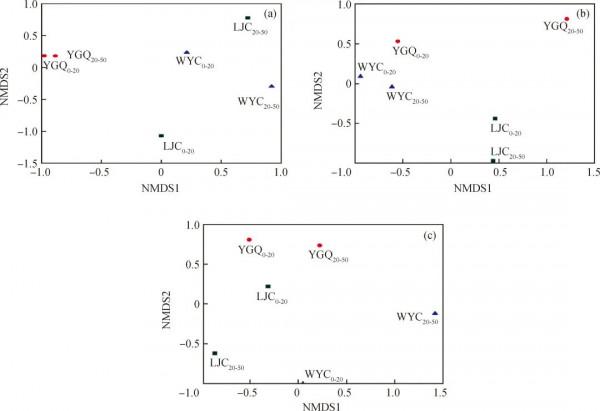
NMDS—Nonmetric multidimensional scaling
圖4 油汙土壤中微生物群落的NMDS分析
Fig.4 NMDS analysis of microbial community in oil contaminated soil
(a) Fungi; (b) Bacteria; (c) Archaea
2.3 油汙土壤微生物群落結構分析
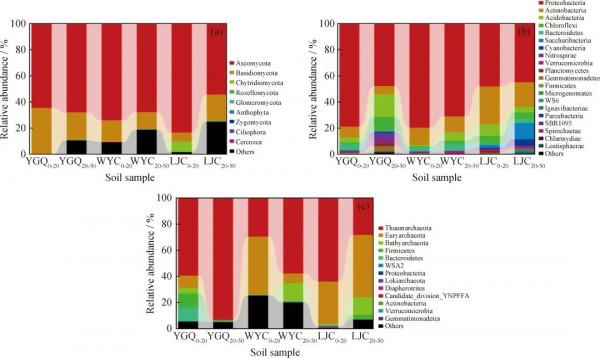
圖5為油汙土壤微生物群落在門水平上的相對丰度(土壤微生物群落相對丰度=單個物種的絕對丰度/整個種群丰度總量)。從圖5(a)可以看出:土壤真菌群落主要隸屬於子囊菌門(Ascomycota)、擔子菌門(Basidiomycota)、壺菌門(Chytridiomycota)等9個門;其中,子囊菌門的相對丰度最大,為54.4%~83.2%;其次為擔子菌門,相對丰度為6.8%~35.5%。已有研究認為能夠降解PAHs的真菌一般多見於子囊菌門、擔子菌門等[24]。陳銳等[15]在研究安塞石油汙染區土壤真菌群落結構分析時同樣發現,在門水平上子囊菌門和擔子菌門為土壤樣品的絕對優勢菌群。
由圖5(b)可見,土壤樣品細菌群落主要隸屬於變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、酸桿菌門(Acidobacteria)、綠彎菌門(Chloroflexi)、擬桿菌門(Bacteroidetes)、螺旋體菌門(Saccharibacteria)、藍細菌門(Cyanobacteria)、硝化螺旋菌門(Nitrospirae)、疣微菌門(Verrucomicrobia)、浮黴菌門(Planctomycetes)、芽單胞菌門(Gemmatimonadetes)、厚壁菌門(Firmicutes)等20個門。其中,相對丰度最高的為變形菌門,為44.8%~79.5%。梁建芳等[13]透過研究表明,克拉瑪依油田石油汙染土壤細菌主要屬於變形菌門、放線菌門、厚壁菌門、擬桿菌門和浮黴狀菌門。劉臻證明厚壁菌門和變形菌門可以石油烴為碳源進行代謝,藍細菌門在石油汙染的水體中能夠很好地利用石油烴作為碳源並維持生長[25]。在對大港油田土壤模擬生物修復過程中同樣發現變形菌門、厚壁菌門、擬桿菌門、綠彎菌門、放線菌門和酸桿菌門是優勢菌門,相對丰度為84.47%~94.66%[26]。
由圖5(c)可見,土壤樣品古菌群落主要隸屬於奇古菌門(Thaumarchaeota)、廣域古菌門(Euryarchaeota)、深古菌門(Bathyarchaeota)、厚壁菌門、擬桿菌門等13個門。相對丰度最大的為奇古菌門,為28.3%~93.1%;廣域古菌門的相對丰度為0.2%~47.3%。宋震等[27]研究表明,原油和含油廢水汙染土壤樣品中的優勢菌門是廣域古菌門,含油廢水和原油都促進了土壤中廣域古菌門的生長和發育,而石油汙染程度較輕的土壤樣品中,優勢菌門是奇古菌門。本研究中同樣發現,石油汙染程度較重的WYC0-20、LJC0-20及LJC20-50土壤樣品中,廣域古菌門相對丰度明顯高於其他樣品,而汙染程度較輕的YGQ0-20和YGQ20-50樣品奇古菌門的相對丰度更大。
Fig.5 Relative abundance of the microbial community phyla in oil contaminated soil samples
(a) Fungi; (b) Bacteria; (c) Archaea
2.4 油汙土壤微生物屬水平上的物種聚類分析
圖6為不同油汙土壤中微生物屬水平上的物種聚類圖(紅色代表在對應樣品中豐富度較高的屬,綠色代表豐富度較低的屬)。石油汙染程度和土壤深度變化會使土壤中優勢菌群發生變化,這是由於土壤深度變化和土壤石油汙染導致土壤中氧含量、壓力以及營養元素髮生了變化[25]。從圖6(a)可以看出:汙染程度最重的WYC0-20土壤樣品中真菌踝節菌屬(Talaromyces)、Phaeoacremonium、柱黴屬(Scytalidium)、絲孢菌屬(Scedosporium)、赭黴屬(Ochroconis)、Sagenomella、念珠菌屬(Candida)相對丰度較大;這些菌屬在汙染程度較輕的YGQ0-20和YGQ20-50土壤樣品中相對丰度較低。而YGQ0-20中丰度較大的刺杯毛孢屬(Dinemasporium)、青黴屬(Penicillium)、外瓶黴屬(Exophiala)以及YGQ20-50中丰度較大的尾梗黴屬(Cercophora)、柄孢殼屬(Zopfiella)、鐮狀瓶黴屬(Harpophora)在WYC、LJC土壤樣品中丰度較低。WYC0-20土壤樣品中踝節菌屬的相對丰度由0提高到31.6%,而青黴屬的相對丰度顯著降低,由44.9%降至0.1%。這說明青黴屬可在石油汙染環境中生存,但汙染程度過高(土壤中油質量分數8.632 g/kg)時不利於其生存。研究人員從油汙土壤或海洋環境中分離出的具有原油降解能力的真菌中就包括踝節菌屬[28]。另外,有報道稱麴黴屬(Aspergillus)對原油中C11~C20的烴鏈有較好的降解作用,外瓶黴屬可降解甲苯、多環芳烴類汙染物,青黴屬和莖點黴屬(Phoma)可降解PAHs,念珠菌屬對正構烷烴降解效果較好[24,29]。
從圖6(b)可以看出,對於細菌,汙染程度較輕的YGQ0-20中丰度較大的鞘脂單胞菌屬(Sphingomonas)、假黃單胞菌屬(Pseudoxanthomonas)、玫瑰單胞菌屬(Roseomonas)、甲基桿菌屬(Methylobacterium)、貪銅菌屬(Cupriavidus)和YGQ20-50中丰度較大的變異桿菌屬(Variibacter)、固氮弓菌屬(Azoarcus)在WYC、LJC土壤樣品中丰度較低。汙染程度最重的WYC0-20中丰度較大的屬有寡養單胞菌(Stenotrophomonas)、硫桿菌屬(Thiobacillus)、慢生根瘤菌屬(Bradyrhizobium)、纖維單胞菌屬(Cellulomonas)。其中,寡養單胞菌的相對丰度由0.1%提升到1.9%,而甲基桿菌屬由10.7%降到0.3%。肖建軍等[30]透過在石油汙染的土壤中篩選出寡養單胞菌並進行實驗發現,其對甲苯有較好的去除效果。土壤樣品中細菌屬水平丰度較高的分枝桿菌(Mycobacterium)、假單胞菌屬(Pseudomonas)都是能夠降解石油烴的細菌菌屬[25]。
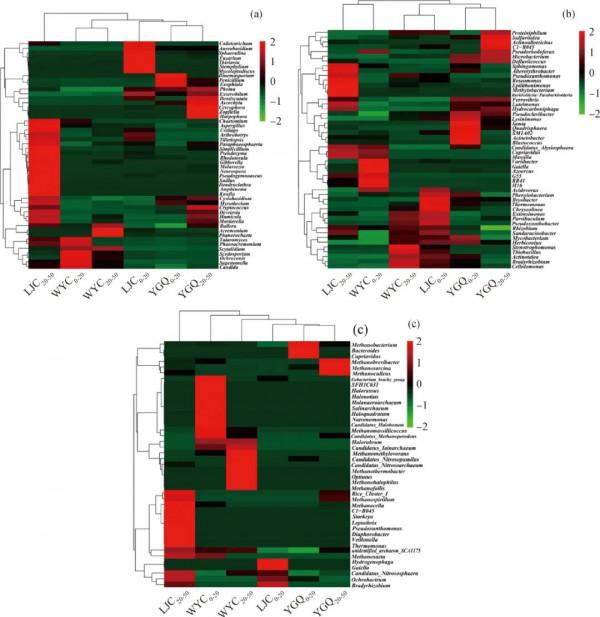
Red represents the genera with high abundance in the corresponding samples, and green represents the genera with low abundance.
圖6 油汙土壤中群落屬水平聚類圖
Fig.6 Horizontal cluster diagram of community genera in oil contaminated soil samples
(a) Fungi; (b) Bacteria; (c) Archaea
從圖6(c)可以看出,對於古菌,各取樣點高丰度交叉菌屬較少。汙染程度最輕的YGQ0-20中丰度較大的屬有甲烷桿菌屬(Methanobacterium)、擬桿菌屬(Bacteroides)。而汙染程度最重的WYC0-20中丰度最高的屬有甲烷桿菌屬、甲烷八疊球菌屬(Methanosarcina)和甲烷囊菌屬(Methanoculleus)。其中,甲烷八疊球菌屬的相對丰度由5.8%增至37.8%。有文獻表明,產甲烷古菌對石油烴具有厭氧生物降解作用[31],甲烷八疊球菌屬具有降解C12~C30的長鏈正構烷烴的能力[32]。
2.5 油汙土壤微生物群落與土壤烴類組分的相關性
分析油汙土壤中正構烷烴和芳香烴含量與真菌、細菌、古菌屬水平微生物群落的關係,對存在顯著相關關係(顯著水平PColletotrichum)、細菌節桿菌屬(Arthrobacter)、假枝桿菌(Pseudoclavibacter)、古菌鹽紅菌屬(Halorubrum)與烷烴含量呈顯著正相關;而真菌柄孢殼屬(Zopfiella)、古菌擬桿菌屬(Bacteroides)與烷烴含量呈顯著負相關性。對於芳香烴,細菌甲基桿菌屬(Methylobacterium)與苯、萘、菲、芘、二苯並噻吩含量呈顯著正相關性,古菌甲烷八疊球菌屬與苯、萘、菲、芘、
、二苯並噻吩含量呈正相關性,擬桿菌屬(Bacteroides)與蒽、芴含量呈正相關性;真菌腐殖黴屬(Humicola)和被孢黴屬(Mortierella)與苯、萘、菲、芘、
含量呈顯著負相關性。

BEN—Benzene; NAP—Naphthalene; PHE—Phenanthrene; PYR—Pyrene; CHR—Chrysene;ANT—Anthracene; FLU—Fluorene; DBT—Dibenzothiophene
圖7 油汙土壤微生物群落與烴類組分含量的相關性分析
Fig.7 Correlation analysis of microbial community and hydrocarbon components in oil contaminated soil samples
(a) Alkanes; (b) Aromatic hydrocarbons
3 結 論
(1)東營某煉油廠石油汙染土壤中細菌、真菌和古菌的群落OTU數量隨著土壤油含量的增加先增多後減少,群落結構的Beta多樣性指數與土壤油含量有一定相關性,受汙染程度相近的土壤樣品,其微生物群落結構的相似度較高。
(2)油汙土壤樣品真菌群落中子囊菌門(Ascomycota)和擔子菌門(Basidiomycota)的相對丰度最大;細菌群落中相對丰度最高的為變形菌門(Proteobacteria);古菌群落中相對丰度最大的為奇古菌門(Thaumarchaeota)和廣域古菌門(Euryarchaeota)。隨著土壤油含量增加,真菌踝節菌屬(Talaromyces)的相對丰度由0提高到31.6%;細菌寡養單胞菌(Stenotrophomonas)由0.1%提升到1.9%;古菌群落中甲烷八疊球菌屬(Methanosarcina)的相對丰度由5.8%增至37.8%。
(3)微生物群落結構與土壤中烴類組分含量相關性分析表明,真菌炭疽菌屬(Colletotrichum)、細菌節桿菌屬(Arthrobacter)、假枝桿菌(Pseudoclavibacter)、古菌鹽紅菌屬(Halorubrum)與烷烴含量呈顯著正相關性,而真菌柄孢殼屬(Zopfiella)、古菌擬桿菌屬(Bacteroides)與烷烴含量呈顯著負相關性;細菌甲基桿菌屬(Methylobacterium)和古菌甲烷八疊球菌屬(Methanosarcina)、擬桿菌屬(Bacteroides)與芳烴含量呈正相關性,真菌腐殖黴屬(Humicola)和被孢黴屬(Mortierella)與芳烴含量呈顯著負相關。
文章來源:土行者
免責宣告:以上內容轉載自生態修復網,所發內容不代表本平臺立場。
全國能源資訊平臺聯絡電話:010-65367702,郵箱:[email protected],地址:北京市朝陽區金臺西路2號人民日報社