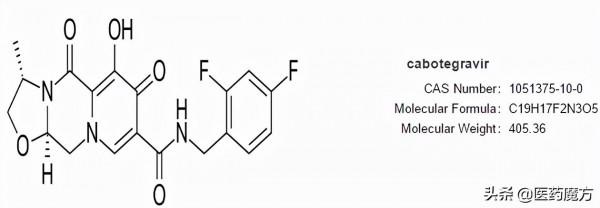
12月20日,GSK旗下ViiV Healthcare宣佈,美國FDA批准Apretude(Cabotegravir緩釋注射用混懸液)上市,用於體重至少35公斤(77磅)的高危成年人和青少年暴露前預防(PrEP) ,以降低性感染艾滋病毒(HIV)的風險,這些患者具有經性途徑感染HIV的風險且HIV-1檢測呈陰性。Apretude是FDA批准的首款長效HIV暴露前預防注射療法,此前曾獲FDA突破性療法認定,優先審評資格。
艾滋病毒仍然是全球公共衛生危機,估計全世界有3800萬人感染艾滋病毒,每年有170萬新病例。PrEP是減少HIV新發病例的有效途徑,將有助於結束HIV流行。然而,在美國,目前只有不到25%的人能夠從PrEP中獲益,儘管每日口服的PrEP藥物已被廣泛使用,但仍會受到依從性以及文化障礙的限制。
Apretude是一款兩個月注射1次的長效HIV預防新藥,可使HIV預防藥物的給藥頻率從每年365次降為每年6次。
Apretude透過注射形式給藥,每年注射次數最少為6次,最初用藥劑量為每月注射1次(600mg,3ml),連續兩個月。之後,每兩個月注射1次。患者可在開始首次注射前服用Vocabria(cabotegravir口服片劑)約一個月,以評估藥物的耐受性。
美國FDA的批准是基於兩項國際IIb/III期多中心、隨機、雙盲、活性對照HPTN 083和HPTN 084試驗的結果,該試驗評估了長效cabotegravir在透過性行為感染艾滋病毒的高風險患者的PrEP的安全性和有效性。
經評估,Apretude在預防HIV感染方面優於每日口服恩曲他濱/富馬酸替諾福韋二吡呋酯片劑 (FTC/TDF,Truvada),分別將預防HIV感染方面的效力提高了69%和90%。在獨立資料安全監測委員會的建議下,兩項研究的盲法、隨機試驗部分提前終止。
GSK的Apretude對吉利德的口服PrEP藥物Truvada和Descovy(恩曲他濱丙酚替諾福韋)構成了威脅。去年Truvada失去了在美國的獨佔權後,銷售額在第二季度暴跌72%,至1.08億美元。與此同時,隨著對新型藥物Descovy需求的增長,該藥物第二季度的銷售額增長了4%,達到4.35億美元。