12月21日,國家藥品監督管理局(NMPA)公示顯示,國產抗PD-L1單抗舒格利單抗的新藥上市申請已獲批准,適用於聯合培美曲塞和卡鉑用於表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性的轉移性非鱗狀非小細胞肺癌(NSCLC)患者的一線治療,以及聯合紫杉醇和卡鉑用於轉移性鱗狀NSCLC患者的一線治療。
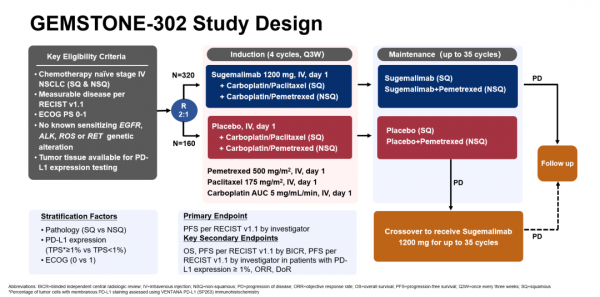
舒格利單抗(CS1001)是一種高親和力的全人源化,全長抗PD-L1的IgG4單克隆抗體,分子量更大、半衰期更長、有更好的體內穩定性,可以選擇性結合PD-L1,阻滯PD-L1/PD-1配體。該批准是基於多中心、隨機、雙盲的III期研究GEMSTONE-302的積極結果,該研究旨在評估舒格利單抗聯合化療對比安慰劑聯合化療,在未經一線治療的、IV期NSCLC患者中的有效性和安全性。
2020年8月,GEMSTONE-302研究在計劃的期中分析中,經獨立iDMC評估達到了預設的主要研究終點,即與安慰劑聯合化療相比,舒格利單抗聯合化療顯著延長了無進展生存期(PFS),將疾病進展或死亡風險降低50%。2021年世界肺癌大會(WCLC)上,GEMSTONE-302研究主要研究者、同濟大學附屬上海市肺科醫院周彩存教授以口頭報告的形式分享了GEMSTONE-302研究的最終PFS結果和初步總生存(OS)資料。
GEMSTONE-302研究納入既往未接受過化療、有可測量病灶(根據RECIST v1.1)、ECOG體力狀況(PS)評分為0-1、無已知EGFR/ALK/ROS/RET突變、腫瘤組織可用於檢測PD-L1表達的IV期NSCLC(鱗狀和非鱗狀)患者。以2:1隨機分配至舒格利單抗聯合化療組(n=320)或安慰劑聯合化療組(n=160)。
截至2021年3月15日,中位隨訪18個月,在納入的479例患者中,24.7%的患者仍在接受舒格利單抗聯合化療治療,7.5%的患者仍在接受安慰劑聯合化療治療。
研究結果顯示,在所有包含鱗狀和非鱗狀NSCLC患者中,舒格利單抗聯合化療可延長中位PFS達4.1個月;舒格利單抗組和安慰劑組研究者評估的中位PFS分別為9.0個月和4.9個月(HR 0.48),12個月PFS率分別為36.4%和14.8%。
來源:WCLC
舒格利單抗組和安慰劑組研究者評估的客觀緩解率(ORR)分別為63.4%和40.3%,兩組中位緩解持續時間(DoR)分別為9.8個月和4.4個月。OS資料尚未成熟,但獲益趨勢顯著。舒格利單抗組和安慰劑組的初步OS分別為22.8個月和17.7個月(HR 0.67),24個月OS率分別為47.1%和38.1%。
在所有的亞組中均觀察到顯著的PFS獲益。在鱗狀NSCLC患者中,舒格利單抗組和安慰劑組的中位PFS分別為8.3和4.8個月(HR 0.34);在非鱗狀NSCLC患者,兩組中位PFS分別為9.6和5.9個月(HR 0.59)。同樣,無論PD-L1表達水平如何,舒格利單抗組相比安慰劑組的PFS均有獲益:在PD-L1<1%的患者中,兩組中位PFS分別為7.4和4.9個月(HR 0.55);在PD-L1 1%~49%的患者中,中位PFS分別為8.8和4.8個月(HR 0.53);在PD-L1≥50%的患者中,中位PFS分別為12.9和5.1個月(HR 0.41)。
安全性方面,舒格利單抗聯合化療的安全性良好,未發現新的安全性訊號。舒格利單抗組和安慰劑組≥3級治療相關不良事件(TEAE)發生率分別為64.1%和61.6%。
GEMSTONE-302研究顯示,舒格利單抗聯合化療的療效優異,安全性可靠。此次獲批,為鱗狀和非鱗狀IV期NSCLC患者提供了一線治療新選擇。
參考文獻:
1.國家藥品監督管理局官網
2.Zhou CC, et al. 2021 WCLC, MA13.07 – GEMSTONE-302: A phase 3 study of platinum-based chemotherapy with placebo or Sugemalimab, a PD-L1 mAb, for metastatic NSCLC.
投稿郵箱:[email protected]