鐵蛋白(Fn)是一種具有獨特空腔和孔道結構的內源性蛋白,可以作為天然的藥物載體。腫瘤細胞表面通常高表達鐵蛋白受體,藉助該識別途徑可實現藥物向腫瘤細胞的靶向遞送。然而,鐵蛋白受體在肝臟等正常組織也會非特異性表達,影響了鐵蛋白向實體腫瘤遞送藥物的效率。近日,中國科學院過程工程研究所生化工程國家重點實驗室研究員魏煒團隊提出利用仿生礦化策略使鐵蛋白表面生長出磷酸鈣外殼,藉助“隱形”作用避免了肝臟過表達鐵蛋白受體產生的截留效應,提高了實體腫瘤的靶向能力。該體系還可以協同調控實體腫瘤內微環境,並可按需裝載不同種類的抗腫瘤藥物,在多種小鼠模型上顯著提高治療效果。相關成果發表在Advanced Materials上。
該團隊首先收集臨床樣本,透過免疫熒光染色證實鐵蛋白受體在實體腫瘤和肝臟中均有較高的表達水平,並透過實驗證實這種非特異性表達會帶來肝臟的截留效應,降低鐵蛋白向實體腫瘤的富集。為了解決上述難題,研究團隊提出了仿生礦化的新策略,在鐵蛋白表面原位生長出生物安全性好的磷酸鈣“隱形外殼”。以此獲得的礦化鐵蛋白(Fn@CaP)靜脈注射後成功遮蔽了肝臟中鐵蛋白受體的識別作用,顯著降低了肝臟的截留效應,並增加了其向實體腫瘤的富集。
當Fn@CaP到達實體腫瘤後,還可以顯著調節腫瘤微環境。首先,腫瘤細胞代謝產生的乳酸使得磷酸鈣外殼溶解,這個過程會消耗氫離子,進而有效改善腫瘤酸性微環境。其次,酸性微環境的改善可以促進M2型巨噬細胞向M1型極化,從而改善腫瘤免疫抑制微環境。另外,磷酸鈣外殼溶解產生的大量鈣離子還可以進一步促進腫瘤的鈣化。
除了上述功能,Fn@CaP載體還可以按需裝載不同的抗腫瘤藥物。例如,鐵蛋白內腔可以基於原位成核方式高效裝載化療藥物三價砷,在患者來源的異種移植瘤(PDX)模型中有效抑制腫瘤的生長。進一步,磷酸鈣外殼可透過配位方式高效負載光敏劑吲哚菁綠(ICG),藉助化療和光熱治療的聯合,在PDX模型中完全抑制難治型腫瘤的生長。
近五年,該研究團隊提出了仿生劑型工程的新策略,基於蛋白、細菌、細胞等體內組分發現和創制了一系列仿生遞送新劑型,藉助固有的天然路徑實現體內的精準遞送,在動物模型上成功用於靶向治療、免疫治療和個體化治療,並且部分劑型已透過醫院倫理批准進入個體化臨床前和臨床研究。
該工作得到了國家自然科學基金和國家重點研發計劃專案的支援。
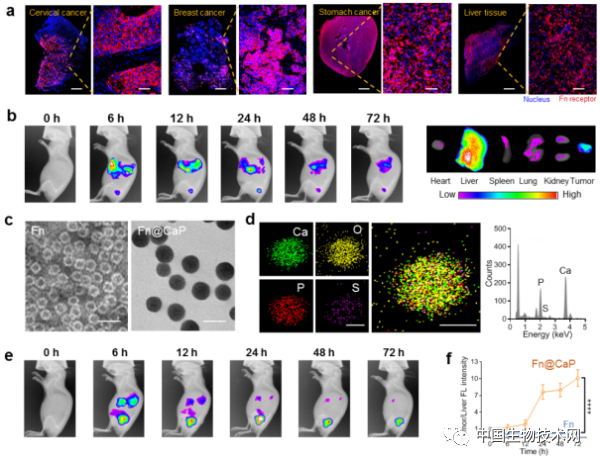
圖1 肝臟對鐵蛋白的截留效應、Fn@CaP的構建及其靶向性分析。(a)腫瘤和肝臟組織鐵蛋白受體表達水平的免疫熒光分析(標尺:左圖2 mm;右圖100 μm);(b)Fn的體內分佈成像;(c)Fn和Fn@CaP的TEM影象(標尺:30 nm);(d)Fn@CaP的元素分佈(標尺:10 nm)和能譜分析;(e)Fn@CaP的體內分佈成像;(f)Fn和Fn@CaP的腫瘤和肝臟熒光比值變化曲線

圖2 仿生礦化鐵蛋白腫瘤微環境調節分析。(a)小鼠腫瘤組織多光譜成像圖及其對應的pH值統計;(b)瘤內M1和M2細胞比例的流式分析;(c)小鼠瘤內鈣化的CT成像及訊號統計
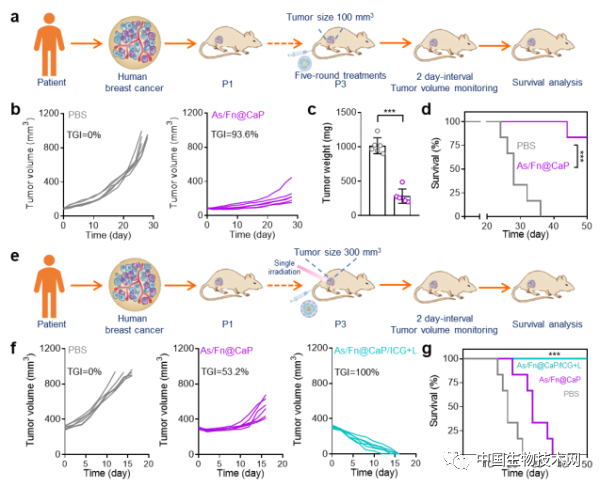
圖3 Fn@CaP按需裝載不同藥物後在PDX模型中的藥效分析。(a)內腔裝載三價砷的Fn@CaP用於PDX治療的藥效評價示意圖;(b)小鼠腫瘤生長曲線;(c)小鼠腫瘤重量統計;(d)小鼠生存曲線;(e)外殼裝載ICG且內腔裝載三價砷的Fn@CaP用於難治型PDX治療的藥效評價示意圖;(f)小鼠腫瘤生長曲線;(g)小鼠生存曲線
2020年熱文精選
1. 杯具了!滿滿一紙杯熱咖啡中,滿滿的塑膠微粒…
2. 美英澳科學家《自然醫學》再添力證:新冠病毒乃自然進化產物,或有兩種起源…
3. NEJM:間歇性禁食對健康、衰老和疾病的影響
4. 一年內治癒失眠!研究發現:改善睡眠,你或許只需要一條沉重的毯子
5. 哈佛新研究:僅12分鐘的劇烈運動,能為健康帶來巨大的代謝益處
6. 第一項人類干預試驗:在大自然裡“摸爬滾打”28天,足以提高免疫力
7. 垃圾食品是“真.垃圾”!它奪走了端粒長度,讓人老得更快!
8. Cell解謎:不睡覺真的會死!但致死的變化不是發生在大腦,而是腸道…
9. 《自然通訊》超大規模研究:血液中鐵的水平是健康與衰老的關鍵!
10. 不可思議!科學家一夜之間逆轉動物“永久性”腦損傷,還讓老年大腦恢復了年輕態…