導讀:2021年中國罕見病大會18日訊息,國家醫療保障局自2018年成立以來,連續4年每年一次動態調整醫保藥品目錄,累計將507種新藥、好藥納入了目錄,透過目錄調整實現了用藥保障範圍不斷擴大和結構最佳化。截至目前,國內共有60餘種罕見病用藥獲批上市,其中已有40餘種被納入了國家醫保目錄,涉及25種疾病。
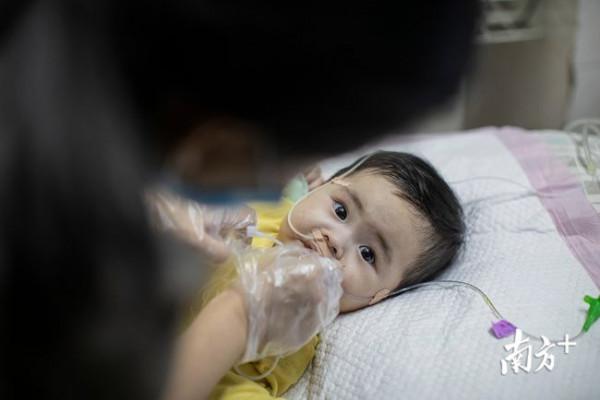
照片中的孩子叫“米粒”,是遺傳性罕見病“脊髓性肌萎縮症(SMA)”的小患者。
剛出生時,“米粒”很愛笑,大大的眼睛總是靈動打量四周。然而第三個月起,媽媽杜佳發現孩子不愛動了,肢體無力,呼吸和吞嚥能力減弱,哭啼聲也不如起初那般洪亮。
在排除了腦癱等疾病後,杜佳聽從醫生建議,帶孩子到深圳做基因檢測,最終得到了SMA確診報告。
幸運的是,這種罕見病的特效藥剛剛被研發出來不久,但不幸的是,70萬元一針的諾西那生納,“米粒”必須終身用藥。
在今年3月的報道中,南方+採訪“米粒的媽媽杜佳,報道了這位堅強的媽媽在社會各界幫助下給“米粒”奔走治療的故事。
好訊息在12月3日傳來,國家醫療保障局釋出2021版國家醫保目錄,將特效藥諾西那生納(Nusinersen)納入,大幅減輕治療負擔。
12月18日,香港《南華早報》刊出相關報道,也分析了“米粒”得救背後的故事。
11月16日,來自廣東茂名的32歲年輕媽媽杜佳在社交媒體平臺“小紅書”上釋出了她的二寶“米粒”的影片。
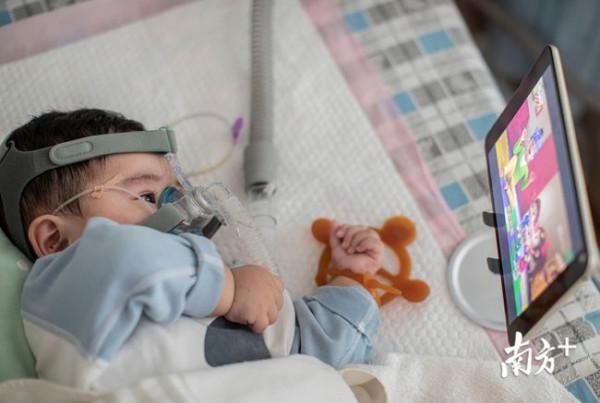
影片中,小“米粒”伸手去抓玩具,這對大多數19個月大的寶寶來說是一種本能動作,但對於患有脊髓性肌萎縮症(SMA)的人來說,卻是一個不可能完成的壯舉。
來自馬薩諸塞州劍橋市的百健(Biogen)公司開發的藥物諾西那生納(Nusinersen),是“米粒”目前唯一的救命藥。“在14個月之前,他的手和腳是不能動的,注射諾西那生納之後才好了一些”,杜佳說道。
但代價是巨大的,諾西那生納(Nusinersen)注射液是全球首個SMA精準靶向治療藥物,2019年獲批准國內上市,給SMA患兒帶來一線生機的同時,每支69.97萬元的售價也創下了中國藥品的新紀錄。第一年注射6針,往後每年注射3針,終身用藥。

以“Sprinraza”品牌銷售的諾西那生納(Nusinersen)是全球首個獲批用於治療脊髓性肌萎縮症的治療藥物,這是一種遺傳性疾病,在中國約有30000名患者,其特徵是脊髓和下腦幹中的運動神經元喪失,可導致嚴重的、持續性的 肌肉萎縮和虛弱。
目前這種藥已經在全球50個國家和地區獲批使用,2019年在國內獲批上市,每支售價69.97萬元,第一年注射6針,往後每年注射3針,終身用藥。像杜佳這樣的工薪家庭,大多是用不起這種藥的。
“藥品(生產商)、(慈善機構)中國初級衛生保健基金會和市政府給我們提供了一些支援,第一年6針的總價給我們降到了70萬元,但這還是一個沉重的負擔”,杜佳說道,“我們想盡了辦法,透支11張信用卡,還向父母借錢,才湊齊了這70萬,但下一筆70萬又是一個問題,因為‘米粒’是終身用藥的。”
好訊息在12月3日傳來,國家醫療保障局釋出2021版國家醫保目錄(共計74種藥品新增進入目錄,11種藥品被調出目錄。2021年國家醫保藥品目錄內藥品總數2860種,將於2022年1月1日執行,觀察者網注)。 這是一份國家醫保計劃覆蓋的藥品目錄,在百健公司同意將價格下調 95% 後,Sprinraza成為今年新列入目錄的 74 種藥物之一。百健對此沒有發表評論。
國家醫保目錄已有20多年曆史,1998年,“國務院關於建立城鎮職工基本醫療保險制度的決定”釋出,決定指出“保障職工基本醫療,是建立社會主義市場經濟體制的客觀要求和重要保障”。2017年,目錄經過較大調整,也成為“共同富裕”目標願景的一部分。
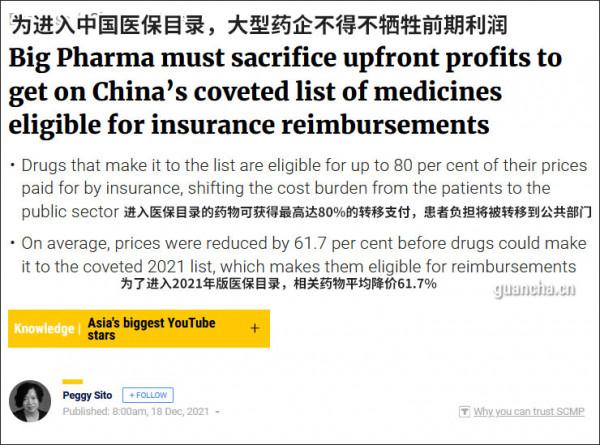
被列入目錄的藥物可以由醫保資金覆蓋70%-80%的價格,從而將醫療成本負擔從患者轉移到公共部門,但被列入目錄的藥品通常需要在源頭上降價。
“許多製藥公司(渴望)將他們的藥物新增到醫保目錄中,因為這有助於提高患者支付能力,能夠一舉克服許多障礙,讓藥品能夠為患者使用,這有助於藥企增強市場競爭力”,戰略諮詢公司西蒙顧和(Simon-Kucher & Partners)合夥人Bruce Liu分析,“如果企業追求透過列入醫保目錄實現增長,大都能夠取得成功。”
本月初宣佈將於1月1日實施的最新醫保目錄包括2860種藥物,其中西藥1486 種,中藥1374種。
在今年新增的74種藥物中,只有7種藥物是被直接加入的,其餘67種藥物都經過了多輪價格談判,使平均價格較列入清單前下降了61.7%,這些藥包括傳染病藥物、放射造影劑、腫瘤藥和罕見病藥等等。
瑞士信貸表示,除了上面提到的百健(Biogen)生產的Sprinraza,恆瑞醫藥、百濟神州、榮昌生物等中國藥企的一些新藥也進入了2021版目錄。Bruce Liu表示,大多數藥物在列入醫保目錄後會出現銷量的大幅增長,藥企的營收會因此大幅提高,雖然要達到這個目標必須降低單價。
科學和智慧財產權服務商科睿唯安(Clarivate China)在報告中寫道,瑞士製藥巨頭羅氏 (Roche)在2017年被納入醫保目錄後的兩年內,其乳腺癌和胃癌治療藥物赫賽汀(Herceptin)的銷售額翻了一番,抗癌藥物阿瓦斯汀(Avastin )的銷售額翻了三倍,即使這些藥物的單價都下降了60%。
有證據表明,在價格具有彈性的市場中,為列入中國醫保目錄而大幅降低單價是有利可圖的,中國城市地區可支配收入中位數為13120元,比一年前增長12%,農村地區收入大致為上述資料的1/2。
近年來,中國醫藥市場持續增長。市場調研公司大雪諮詢(Daxue Consulting)1月釋出的報告指出,預計到2023年,中國醫療市場總量將達1618億美元,約佔全球市場總量的30%,2018年這一比例僅為11%。
報告認為,這個全球第二大醫藥市場高度分散,約5000家藥企(主要是中小企業)在多個細分市場激烈競爭,這成為諾華、諾和諾德和阿斯利康等全球製藥巨頭搶佔市場份額的巨大空間。
為了讓國內的藥企佔據優勢,中國衛生服務部門正在敦促這些企業儘快將他們的產品新增到醫保目錄中。 和黃醫藥(HUTCHMED)執行長賀雋(Christian Hogg) 表示,“醫保目錄使創新藥能夠迅速在全國範圍內廣泛應用。”該公司主要開發用於癌症和免疫疾病的靶向療法和免疫療法。
“我們看到,越來越多中國企業正在創新藥研發方面與跨國企業競爭,每一版醫保目錄更新,自主研發藥物都會增加一些”,賀雋說道,該公司有兩種藥物在醫保目錄中,一種是去年列入,今年成功續約的愛優特(ELUNATE),用於治療轉移性結直腸癌,另一種是今年剛剛列入,用於治療晚期非胰腺神經內分泌腫瘤的蘇蘭達(Sulanda)。但和黃醫藥拒絕透露這兩種藥品的降價幅度。而該公司與合作伙伴阿斯利康(AstraZeneca)共同開發的非小細胞肺癌藥物沃瑞沙(ORPATHYS)沒有列入醫保目錄,和黃醫藥也拒絕對此詳細說明。
不願進入醫保目錄的藥物不止沃瑞沙(Orpathys),兩家嵌合抗原受體 (CAR-T) 細胞療法生產商,復星凱特生物和藥明巨諾(JW Therapeutics)也都不願將其藥品列入目錄,雖然他們的藥物已經獲得國藥監局的批准。他們的產品用於治療成年複發性或難治性瀰漫性大B細胞淋巴瘤患者,這種疾病的五年存活率約為42%至50%。
“這種療法在其他國家的價格約為250萬元人民幣”,復星凱特的一位發言人表示,“我們的產品(價格120萬元)是完全創新的,價格是全球最低的。”
藥明巨諾由藥明康德集團和美國朱諾治療公司於2016年共同建立,雙方分別持有藥明巨諾50%的股權,該公司也不急於將產品納入醫保目錄。
“如果我們的藥物能夠獲得政府補貼,我們當然很高興,這在我們的願望清單上”,藥明巨諾董事長兼執行長李怡平表示,但問題的關鍵是降價幅度、銷量和各方預期前景之間的複雜關係,這是醫保目錄談判中的主要博弈空間。
“創新藥研發具有更大的風險,細胞療法是一種新的概念,它可以挽救生命,但生產成本很高”,李怡平表示,“投資者期望獲得投資回報,所以我們必須在某些年份確保盈利。現階段我們還不能降價,政府的目標價與我們能夠給出的報價存在脫節。”
“納入醫保目錄是一個自願過程”,西蒙顧和合夥人Bruce Liu表示,“如果企業認為某項合作沒有商業價值,他們可以選擇退出,實際操作中也確實如此”。
可以肯定的是,被納入醫保目錄並非進入中國市場的唯一途徑,有市場分析認為,商業保險和其他政府支援也正在幫助藥品供應。還有地方政府與商業保險公司合作,為患者提供定製的醫療保險計劃,這能夠成為醫保的有益補充。
復星凱特也表示,他們正在與商業保險公司合作,將產品納入這些保險的覆蓋範圍,在蘇州,當地政府的醫療保險可以覆蓋CAR-T治療,最高報銷比例可達70%。
隨著諾西那生納被納入醫保,杜佳為“米粒”注射治療SMA的經濟負擔已經大為減輕。
“現在每針售價3.3萬元,現在我每年大約只需自己支付3-4萬元就能打完3針”,杜佳說,“真的要感謝政府把這種藥納入醫保”。
新華社記者從18日在京舉行的2021年中國罕見病大會了解到,截至目前,國內共有60餘種罕見病用藥獲批上市,其中已有40餘種被納入國家醫保藥品目錄,涉及25種疾病。
自2018年成立以來,國家醫療保障局每年一次動態調整醫保藥品目錄,罕見病用藥也在調入之列。同時,透過對罕見病藥品談判准入,罕見病用藥價格大幅降低。國家醫療保障局副局長李滔在會上介紹,2021年共有7個罕見病藥品談判成功,價格平均降幅達65%。
據有關機構估計,我國現有各類罕見病患者約2000萬人,每年新增患者超過20萬人。面對日益龐大的罕見病患者群體,用藥保障的步伐必須不斷加快。
近年來,我國對罕見病治療藥品實施優先審評審批。國家藥品監督管理局將具有明顯臨床價值的防治罕見病的創新藥和改良型新藥納入優先審評審批程式。
本文系觀察者網獨家稿件,未經授權,不得轉載。