2021年歐洲腫瘤內科學會年會(ESMO 2021)於當地時間9月16日-21日舉行。近年來,抗體藥物偶聯物(ADC)在乳腺癌領域的發展可謂風頭無兩。T-DXd作為新一代ADC藥物,對比T-DM1的DESTINY-Breast03研究成果,於9月18日在ESMO全體大會(Presidential Symposium)上進行了口頭報告。
靶向治療不可避免出現耐藥,如何延緩耐藥和進一步提高療效是目前改善乳腺癌患者生存的瓶頸。T-DM1是首個在實體瘤領域獲批的ADC,更是首個應用於乳腺癌抗HER2治療的ADC藥物。基於EMILIA研究資料,《美國國家綜合癌症網路(NCCN)乳腺癌指南》、《ESO-ESMO晚期乳腺癌國際共識指南(ABC5)》等多項國際指南均將T-DM1作為HER2陽性晚期乳腺癌的二線標準推薦。
T-DXd是一種靶向HER2的ADC。基於DESTINY-Breast01 (NCT03248492)研究結果,T-DXd被批准用於治療HER2陽性晚期乳腺癌患者。
DESTINY-Breast03 (NCT03529110)是一項多中心、開放標籤、隨機III期研究,在既往接受過曲妥珠單抗和紫杉烷治療的患者中比較T-DXd與T-DM1在HER2陽性晚期乳腺癌患者中的療效和安全性。作為首個頭對頭對比ADC藥物二線治療HER2陽性晚期乳腺癌療效與安全性的Ⅲ期臨床研究,DESTINY-Breast03備受關注,這也是T-DXd用於乳腺癌的首項研究報告。
方法:
患者按1:1隨機分組。主要研究終點是經盲態獨立評審委員會(BICR)評估的無進展生存期(PFS)。次要研究終點包括總生存期(OS)、客觀緩解率(ORR)、緩解持續時間(DOR)以及研究者評估的PFS和安全性。
結果:
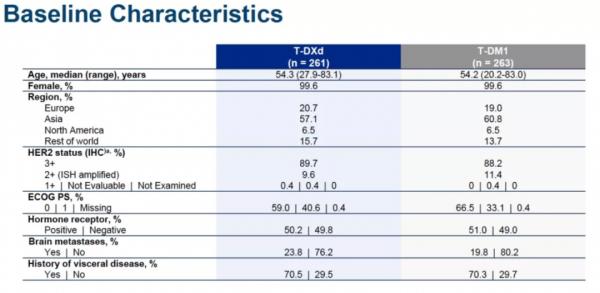
截至2021年5月21日,524例患者參與隨機分組。中位年齡為54歲(範圍20-83歲)。
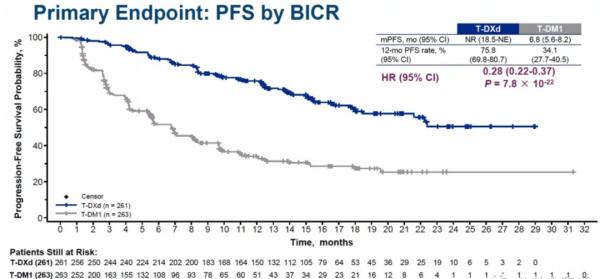
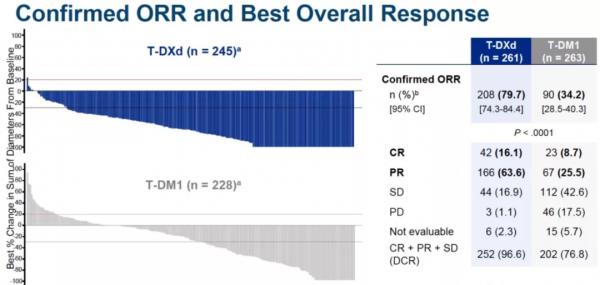
主要終點:T-DXd相比T-DM1,降低疾病復發或死亡風險高達72%(HR 0.2840, 95% CI 0.2165-0.3727,p=7.8×10-22);T-DXd組中位PFS未達到,12個月PFS率為75.8%,而T-DM1組中位PFS為6.8個月,12個月PFS率為34.1%。
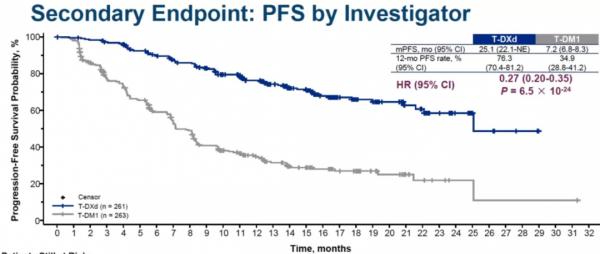
次要終點:T-DXd組研究者評估的PFS為25.1個月,T-DM1組為7.2個月,兩組12個月PFS 率分別為76.3%和34.9%(HR 0.27 ,95% CI 0.20-0.35,P=6.5×10 -24)。T-DXd在所有亞組中均能觀察到PFS獲益。
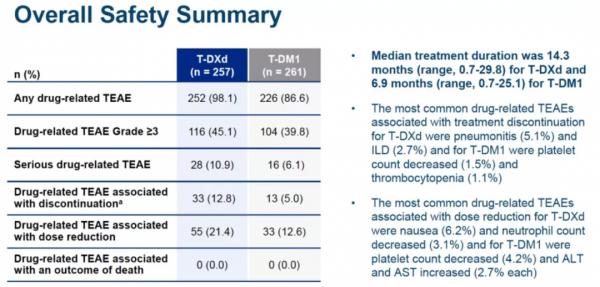
T-DXd組預估的12個月OS率為94.1% (95% CI, 90.3-96.4),T-DM1組為85.9%(95% CI,80.9-89.7)[HR:0.5546(95% CI,0.3587-0.8576;p=0.007172,沒有超出統計顯著性的界限]。T-DXd組的中位治療時間為14.3個月(範圍0.7-29.8),T-DM1組為6.9個月(範圍0.7-25.1)。
T-DXd組ORR達到79.7%,絕大部分患者都可以獲得腫瘤緩解,並且有16.1%的患者達到完全緩解。
在兩組觀察到相似的治療相關不良事件(TRAE)。兩組均未發生藥物相關性死亡。經確認的藥物相關性間質性肺疾病(ILD)在T-DXd組中的發生率為10.5%(大多數[9.7%]為1/2級;無4/5級),在T-DM1組中發生率為1.9% (均為1/2級)。
結論:
在既往接受曲妥珠單抗和紫杉烷治療的HER2+晚期乳腺癌患者中,與T-DM1相比,T-DXd顯示了具有高度統計學意義和臨床意義的PFS改善。研究資料證實,T-DXd可耐受,毒性可控,並且與既往研究中接受過多線治療的重度經治患者相比,ILD顯著改善。
DESTINY-Breast03研究是全球首個在HER2陽性晚期乳腺癌二線治療中與T-DM1進行頭對頭比較並取得具有顯著臨床意義陽性結果的全球多中心Ⅲ期臨床研究,可能會改變HER2陽性晚期乳腺癌二線治療的臨床實踐。
參考文獻:
Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients (Pts) with HER2+ metastatic breast cancer (mBC): Results of the randomized phase III DESTINY-Breast03 study.Presented at: 2021 ESMO Congress; September 16-21, 2021; Virtual. Abstract LBA1.