原位雜交(in situ hybridization)是指將特定標記的已知順序核酸為探針與細胞或組織切片中核酸進行雜交,從而對特定核酸順序進行精確定量定位的過程。基本原理是兩條核苷酸單鏈片段,在適宜的條件下,能過氫鍵結合,形成DNA-DNA、DNA-RNA或 RNA-RNA 雙鍵分子的特點,應用帶有標記的(放射性同位素、熒光素生物素、地高辛等非放射性物質)DNA或RNA片段作為核酸探針,與組織切片或細胞內待測核酸(RNA或DNA)片段進行雜交,然後可用放射自顯影等方法予以顯示,在光鏡或電鏡下觀察目的 mRNA或DNA 的存在並定位。
熒光原位雜交(Fluorescence in situ hybridization,FISH)是以熒游標記取代同位素標記而形成的一種原位雜交方法。因為不需要放射性同位素標記,因此經濟安全;還可以透過不同標記的探針,在同一個樣品中同時檢測多種序列。
熒光原位雜交探針的熒游標記可以採用直接和間接標記的方法。間接標記是採用生物素標記DNA探針,雜交之後用熒光素親和素或者鏈黴親和素進行檢測,同時還可以利用親和素-生物素-熒光素複合物,將熒光訊號進行放大;直接標記法是將熒光素直接與探針核苷酸或磷酸戊糖骨架共價結合,或在缺口平移法標記探針時將熒光素核苷三磷酸摻入。直接標記法檢測步驟簡單,但由於不能進行訊號放大,因此靈敏度不如間接標記的方法。
原位雜交探針分類
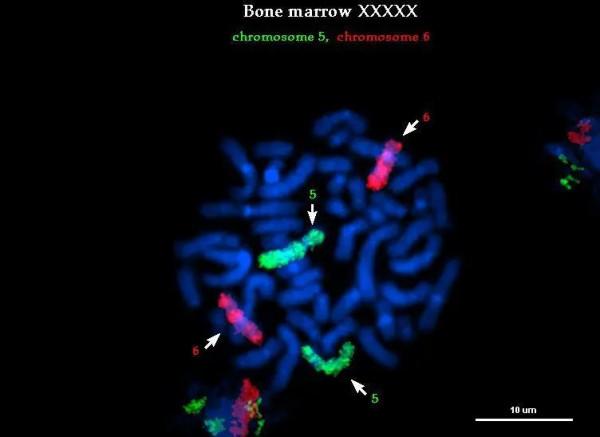
- 染色體特異重複序列探針,主要用於檢測染色體數目異常;
- 全染色體或染色體區域特異性探針,主要用於檢測染色體數目或結構異常;
- 特異性位置探針,用於檢測染色體的易位、缺失等。此外,還有用於特定RNA檢測的人工合成或體外轉錄的探針。
熒光原位雜交實驗的步驟
- 探針變性:將探針在75℃恆溫水浴中溫育5min,立即置0℃,5~10min,使雙鏈DNA探針變性。
- 切片置於65℃下過夜烘烤。
- 二甲苯中室溫脫蠟2次,每次10分鐘,隨後浸入100%乙醇中5分鐘。
- 切片依次室溫置於100%乙醇、85%乙醇和70%乙醇中各兩分鐘覆水。將組織切片室溫浸入去離子水中3分鐘,用無絨紙巾吸取多餘的水分。
- 50℃下用30%酸性亞硫酸鈉(sodium bisulfite )處理組織切片20-30分鐘。
- 於2XSSC溶液中漂洗2次,每次5分鐘。
- 取0.4ml蛋白酶K儲存液(20mg/ml)溶於40ml 20XSSC(pH 7.0)得到蛋白酶K工作液(200µg/ml);將組織切片浸泡在蛋白酶K工作液中,37℃下孵育20-30分鐘。
- 組織切片經蛋白酶K消化後,於2XSSC溶液中漂洗2次,每次5分鐘。
- 將組織切片置於0.1M HCl中室溫浸泡5-10分鐘,於2XSSC溶液中漂洗2次,每次5分鐘。
- 將組織切片玻片依次置於-20℃預冷的70%乙醇、85%乙醇和100%乙醇中各2分鐘脫水。
- 將組織切片室溫浸入丙酮溶液中2分鐘。
- 自然乾燥玻片,加熱玻片至56℃。
- 將已變性或預退火的探針10 μL 滴於已變性並脫水的玻片標本上,蓋上18×18蓋玻片,用Parafilm封片,置於潮溼暗盒中37℃雜交過夜(為防止雜交液蒸發,此過程在溼盒中進行)。
- 將已雜交的玻片標本放置於已預熱42~50℃的體積分數50%甲醯胺/2×SSC中洗滌3次,每次5 min。
- 在已預熱42~50℃的1×SSC中洗滌3次,每次5 min。
- 自然乾燥玻片,DAPI復染。
- 熒光顯微鏡觀察結果。
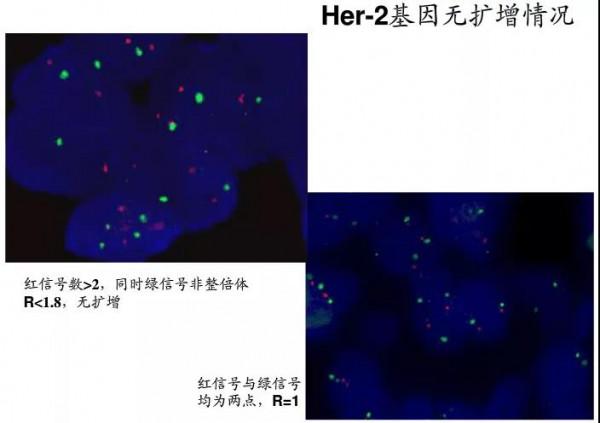
(綠色:染色體著絲粒,紅色:HER2)