你或你周圍的親人朋友是否有過這樣的經歷?反覆發作的呼吸困難、喘息、胸悶或咳嗽。如果是,就需要警惕可能患上了哮喘。
哮喘是全球常見的慢性疾病之一,患病率逐年增加。有資料顯示,哮喘在各個國家發病率為1-18%。全球已有哮喘患者逾4億人,我國20歲及以上哮喘患者人數已達4570萬。然而現有的治療策略下,哮喘的臨床控制依然不理想。因此,針對哮喘發病機制、病理過程以及新治療靶標的研究亟待突破。
浙江大學醫學院附屬第二醫院沈華浩教授、應頌敏教授課題組聯合浙江大學醫學院生物物理學系張巖教授課題組歷經科研攻關,利用冷凍電鏡技術首次成功解析了在哮喘炎症中起到關鍵作用的趨化因子受體CCR1在不同長度的CCL15配體作用下的G蛋白複合物高解析度結構,闡明瞭該受體的內源性配體識別與偏向性訊號啟用機制,為今後靶向CCR1受體的哮喘藥物研發奠定了基礎。
北京時間2021年12月24日,《自然》子刊Nature Chemical Biology線上刊登了這項研究成果。
強強聯合欲解謎團
沈華浩教授和應頌敏教授團隊多年來一直致力於哮喘發病機制與治療研究。早在2003年,沈華浩就率先證實了嗜酸性粒細胞可直接引發哮喘。經過此後十餘年的不懈努力,他們又進一步明確了趨化因子受體CCR1的啟用在哮喘炎症中的關鍵作用,首次提出CCR1及其配體是哮喘治療的新靶標。
然而,近二十年來,所有針對哮喘治療的靶向趨化因子受體的小分子藥物開發,在臨床II期實驗中均告失敗。根據這一現實,結合團隊近十五年對另一趨化因子受體CCR3的研究經驗與教訓,沈華浩說:“從發病機制看,趨化因子受體CCR1及其配體在哮喘發病中起著關鍵作用,但一直沒有成功研發出藥物,因此我們下定決心要在CCR1的結構藥理學方向進行探索,尋找藥物開發失敗的關鍵因素。”
“我們明明已經知道了CCR1受體的啟用在炎症中的關鍵作用,為什麼卻不能完全抑制它?關鍵還在於沒有摸透它的內在機制,所以不能進行精準調控。”應頌敏說,團隊希望能夠深度解析受體與配體相互作用模式資訊,以揭開這個謎團。
趨化因子受體CCR1屬於A類G蛋白偶聯受體(GPCR)。而GPCR是人體中最大的細胞跨膜訊號轉導受體和最重要的藥物靶標。張巖教授課題組長期從事GPCR訊號轉導和結構藥理研究,發展並奠定了基於冷凍電鏡的GPCR結構藥理學,在GPCR結構藥理學領域取得了具有國際影響力的系統性成果。
於是,沈華浩、應頌敏團隊與張巖團隊強強聯合,經歷技術攻關,利用冷凍電鏡技術首次成功解析了CCR1在不同長度的CCL15配體作用下的G蛋白複合物高解析度結構。
關鍵角色浮出水面
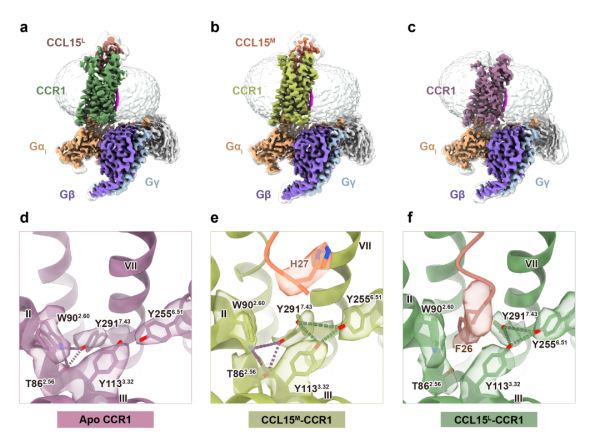
團隊研究發現,炎症狀態下,人體內金屬酶的分泌增加,它就像一把鋒利的刀,可以把CCL15配體切割成不同長度的三種亞型:CCL15L、CCL15M 和CCL15S(圖1)。而這三類因子,就會導向不同的訊號通道,好比它們同樣接到了去遛彎的指令,但最後有的去了東大街,有的去了西廣場。
那為什麼會產生這樣的差異呢?這時候,一個關鍵角色出場了。
高解析度的電鏡密度顯示,位於CCR1正構結合口袋底部的Tyr2917.43氨基酸側鏈在不同配體作用下會表現為截然不同的構象。突變該氨基酸後,CCL15的偏向性訊號轉導特性幾乎完全消失,這就提示Tyr2917.43是介導CCL15對CCR1的偏向性啟用的關鍵氨基酸位點。結合基於結構的功能研究和計算機模擬結果,研究首次闡述了Tyr2917.43 在GPCR的配體識別和訊號轉導中的關鍵作用(圖2)。
“Tyr2917.43就像是一個鐵路扳道工,決定了訊號往哪條通道走。”張巖說,知道了訊號分子如何啟用CCR1,也就明確了下一步如何去阻礙它發揮作用,“之後的哮喘藥物研發可能就會考慮如何把這個‘扳道工’封印住。”
觸類旁通應用延伸
本來這項研究是奔著研發哮喘藥物的目的去的,然而團隊驚喜地發現,Tyr7.43不僅在CCR1的配體識別和訊號轉導中發揮著關鍵作用,序列比對顯示Tyr7.43 在90餘種A 類GPCR中都高度保守併發揮作用,像阿片類受體(μOR,κOR)、血管緊張素受體(AT1R)等。
比如,阿片類受體的配體嗎啡是臨床上用於鎮痛的藥物,但是它的副作用也很明顯,一個是容易上癮,一個是會導致呼吸系統和腸道系統的抑制,如果沒有控制好嗎啡的使用量就會引發嚴重的不良反應甚至是死亡。
而團隊的這項研究系統探索了Tyr7.43位點在受體響應外部訊號啟用中的作用,為今後鎮痛等靶向GPCR的偏向性藥物發現也指明瞭道路,也許未來我們可以研發出療效更好副作用更小的藥物。
沈華浩說:“我們團隊的基礎研究最終目的是為了服務於臨床,以終為始。接下來我們會致力於結構為導向的CCR1靶向小分子藥物的開發,目前團隊也已經在小分子藥物和CCR1的識別機制研究中取得了一定進展。”
浙江大學醫學院附屬第二醫院呼吸與危重症醫學科2017級直博生邵喆嫿、浙江大學基礎醫學院博士後沈慶亞、2019級直博生姚冰鵬為該論文共同第一作者。浙江大學醫學院沈華浩、張巖、應頌敏為該論文共同通訊作者。同時,本工作也得到了浙江大學冷凍電鏡中心和中科院上海藥物研究所徐華強研究員的支援。
論文連結:
https://www.nature.com/articles/s41589-021-00918-z
文字記者:吳雅蘭 | 柯溢能
圖片由受訪者提供
今日編輯:浙江大學融媒體中心學生記者團 葉靜
責任編輯:周亦穎