今天推送的文章發表在Journal of agricultural and food chemistry上的“Directed Mutation of Two Key Amino Acid Residues Alters the Product Structure of the New 4,6-α-Glucanotransferase fromBacillus sporothermodurans”,通訊作者為江南大學生物工程學院的吳敬教授。
澱粉是一種廉價易得的碳水化合物。利用澱粉轉化酶將澱粉轉化為具有特殊結構和性質的產物一直是研究的熱點。4,6-α-葡聚糖轉移酶(4,6-α-GT)可以增加澱粉的α,1→6或α,1→4,6分支點,使澱粉具有消化慢或回生低的特性。探究4,6-α-GT的產物合成過程,對於合成具有新結構和新功能的產物具有重要意義。
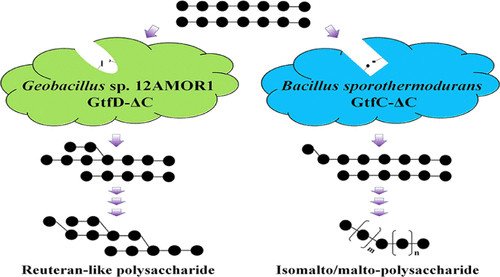
4,6-α-GT是一種新鑑定的酶,屬於糖苷水解酶家族70(GH70),能以澱粉或麥芽糊精為底物進行水解、α,1→4糖基化和α,1→6糖基化反應,以α,1→6糖基化反應為主。不同來源的4,6-α-GTs可以合成α,1→6鍵增加的產物,這些不同結構的產物可以分為兩類。第一種產物是異麥芽/麥芽多糖(IMMP)或異麥芽/麥芽寡糖(IMMO)。IMMP和IMMO都是線性產物,IMMP主要由連續的α,1→6鍵連線的葡萄糖殘基組成,在還原端含有多個由連續α,1→4鍵連線的葡萄糖殘基。典型的IMMP包括使用reuri 121乳桿菌GtfB生產的產物,由於其高α,1→6鍵含量,該IMMP產物具有很高的抗消化性。IMMO具有與IMMP相似的結構,但聚合度(DP)較低,典型的IMMO包括由Exiguobacterium sibiricum255-15 GtfC合成的產物。第二種產物是以Azotobacter chroococcumNCIMB 8003或Paenibacillus beijingensisDSM 24997 GtfD產生的產物為代表的reuteran-like多糖(RLP)。這種高度分支化的RLP由交替的α,1→4和α,1→6鍵連線,主要由含有1到5個α,1→4連線的葡萄糖殘基的麥芽寡糖單元組成,這些單元透過α,1→4,6分支點和單個線性α,1→6鍵相互連線。RLP的α,1→6鍵含量一般低於IMMP。根據序列相似性,4,6-α-GTs可分為GtfB-like和GtfC/D-like兩個亞家族。以E. sibiricum255-15 GtfC為代表的GtfC/D-like亞家族在結構域組織上更接近糖苷水解酶家族13(GH13)的α-澱粉酶。以L.reuteri121 GtfB為代表的GtfB樣亞家族的結構域組織與GH70來源的葡聚糖酶更接近。GtfB-like和GtfC/D-like亞家族4,6-α-GTs都含有四個已知的保守基序(i-iv)。
4,6-α-GTs可應用於膳食纖維的合成、澱粉的抗變性和具有免疫調節功能的寡糖的合成等領域。過去只對10種4,6-α-GTs進行了表徵,對不同結構的4,6-α-GTs產物的催化機理尚不清楚。研究報道GtfX和GtfY可以分別合成RLP和IMMP。這兩個蛋白質的模擬結構顯示了它們活性位點周圍的關鍵環(環A1、環A2和環B)之間的顯著差異,這些差異可能與GtfX和GtfY的產物特性有關。弄清產物結構與蛋白質序列之間的關係是對4,6-α-GTs進行修飾以合成具有所需結構的產物的關鍵。在本研究中,從NCBI資料庫中鑑定了GtfC/D-like 4,6-α-GT亞家族的兩個新成員,來自Geobacillussp. 12AMOR1的GtfD和來自Bacillus sporothermodurans的GtfC,這些酶分別用於合成RLP和IMMP產物。GtfC的兩個關鍵氨基酸殘基(殘基S345和I347)對其產物結構型別起關鍵作用。
作者發現活性位點13附近的環B序列表現出合成IMMP/IMMO與RLP的4,6-α-GTs的獨特特徵。屬於IMMP形成/IMMO形成的4,6-α-GTs的環B序列在第918位含有保守的Ser殘基,而屬於RLP形成的4,6-α-GTs的序列不包含這種保守的Ser殘基,或者環B的部分片段缺失(Figure 1)。因此,作者推測918位氨基酸序列的變異可能會影響產物結構。
作者選擇E. sibiricum 255-15 GtfC作為查詢序列,並進行BLAST搜尋。發現了兩種蛋白:來自Geobacillus sp.12AMOR1的葡萄糖基轉移酶-Si前體和來自B. sporothermodurans的ig樣結構域蛋白。這些蛋白具有較高的序列同源性(76%),但在環B的序列上存在顯著差異(Figure 1)。
經過序列分析,作者發現在B. sporothermodurans序列的環B中存在保守的Ser殘基(S345)(Figure 1),而在Geobacillus sp.12AMOR1序列中,該氨基酸殘基被相同位置的Thr殘基(T346)取代。這兩個序列分別被命名為B. sporothermoduransputative GtfC和Geobacillussp. 12AMOR1 putative GtfD,它們的酶學性質和產物特異性的表徵如下所述。
GtfD和GtfC基因的克隆、表達和純化
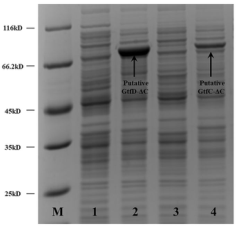
在構建重組表達質粒pET15b-gtfd和pET15b-gtfc後,作者試圖在E. coliBL21(DE3)中生產全長的GtfD和GtfC,但全長編碼序列的表達不能產生可溶性蛋白。然後,作者參考E. sibiricum 255-15 GtfC構建了C端缺失突變體GtfD-ΔC(缺少C-末端氨基酸723-870)和GtfC-ΔC(缺少C-末端氨基酸708-870)。SDS-PAGE分析表明,C端截短提高了GtfD-ΔC和GtfC-ΔC的可溶性表達,分子量分別為79 kDa和80 kDa (Figure S3)。
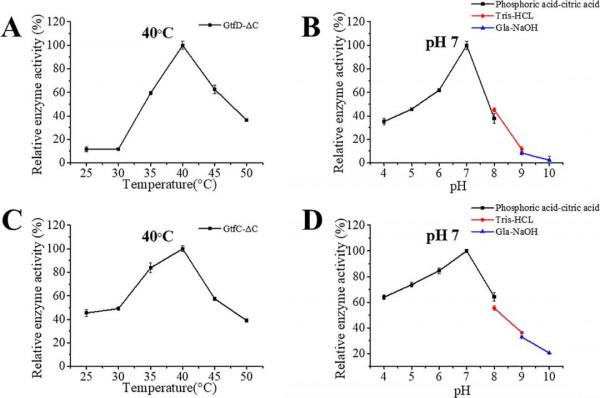
GtfD-ΔC和GtfC-ΔC都催化了直鏈澱粉V的消耗。測定酶活表明,GtfD-ΔC和GtfC-ΔC在40 °C和pH 7.0時對直鏈澱粉V的活性最高,比活力分別為1.8 U/mg和5.1 U/mg(Figure 2)。
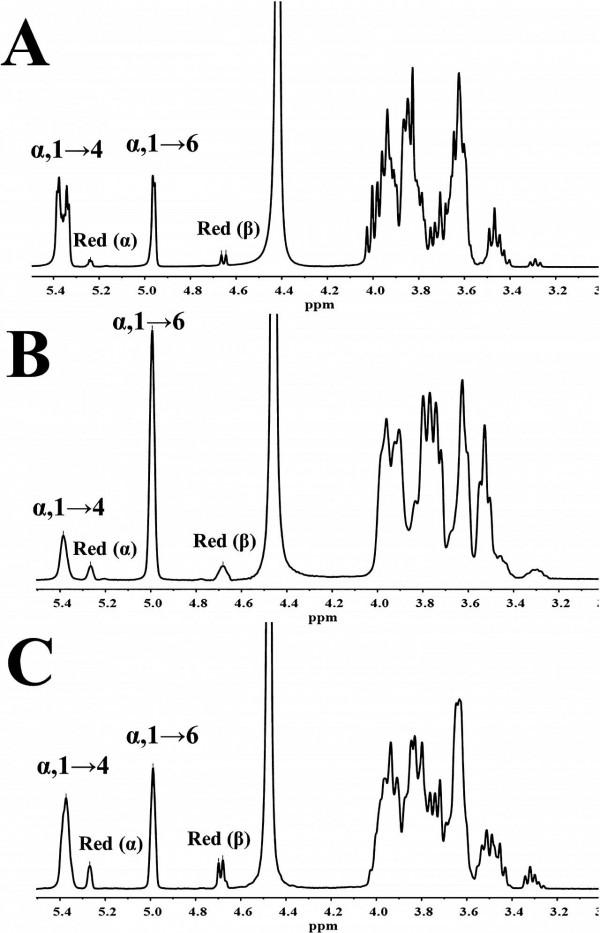
GtfD-ΔC和GtfC-ΔC反應產物的1H NMR譜顯示了α,1→4和α,1→6鍵的訊號(Figure 3A,B)。α,1→4和α,1→6鍵的化學位移分別為δ∼5.38−5.34和δ∼4.97。因此,這兩種蛋白都能將直鏈澱粉V轉化為含有α,1→6鍵的產物。δ∼5.26和δ∼4.68處的峰分別對應於以α和β構象還原葡萄糖殘基的訊號。從δ∼5.38−5.34、δ∼5.26、δ∼4.97和δ∼4.68處的訊號峰面積來看,GtfD-ΔC和GtfC-ΔC反應產物的α,1→6連線:α,1→4連線:還原糖殘基的摩爾比分別為29:64:7%和71:18:11%。此外,在GtfD-ΔC產物的1H NMR譜中,化學位移約為δ∼5.38−5.34的雙峰表明該結構含有由α,1→4和α,1→6鍵連線的D-吡喃葡萄糖分支。在GtfC-ΔC產物的1H NMR譜中,δ∼5.36處的單一訊號峰表明GtfC-ΔC產物中沒有D-吡喃葡萄糖分支。因此,1H NMR譜表明,GtfD-ΔC和GtfC-ΔC產物分別為支鏈產物和直鏈產物。
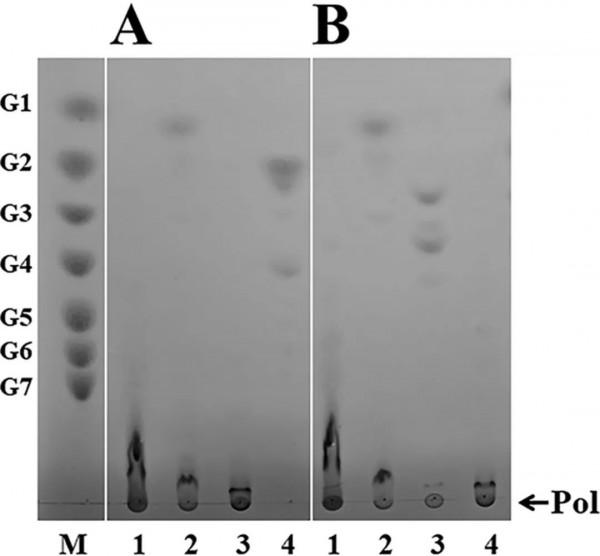
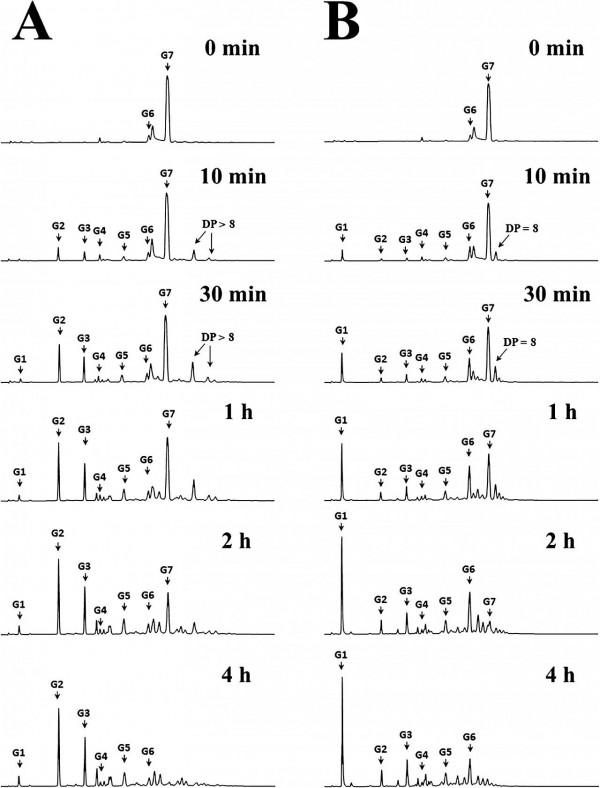
用葡聚糖酶、α-澱粉酶和普魯蘭酶對GtfD-ΔC和GtfC-ΔC的產物進行了酶譜分析。TLC資料(Figure 4)表明,GtfD-ΔC產物用α-澱粉酶水解產生少量葡萄糖,但用葡聚糖酶不產生水解物。普魯蘭酶完全水解GtfD-ΔC產物,生成DP2到DP4的麥芽低聚糖。結合酶指紋圖譜和GtfD-ΔC產物的1H NMR譜,作者證實GtfD-ΔC的產物具有典型的RLP結構。同時,GtfC-ΔC產物可以被葡聚糖酶水解產生IMMO(Figure 4)。含有主要由連續α,1→6鍵連線的葡萄糖殘基和一小部分由連續的α,1→4鍵連線的葡萄糖殘基。
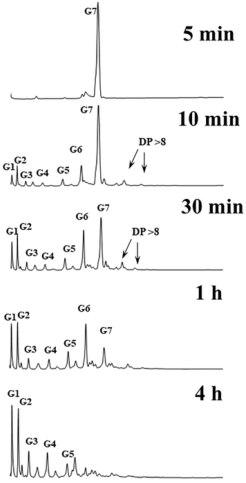
為了研究GtfD-ΔC和Gtfc-ΔC的鏈長轉移模式,作者研究了該酶與麥芽七糖孵育不同時間後的產物。如Figure 5所示,在反應早期(0−30 min),GtfD-ΔC將麥芽七糖轉化為IMMO產物的混合物,其DP為2−5和DP>8。在此過程中,麥芽六糖的含量沒有顯著增加。GtfC-ΔC最初將麥芽七糖大量轉化為葡萄糖、麥芽六糖和DP 8的IMMO產物,而DP 2−5的產物沒有大量產生。隨後(>30 min),GtfD-ΔC產物中積累了大量的麥芽糖和麥芽三糖,而GtfC-ΔC產物中積累了大量的葡萄糖。當反應持續4 h時,GtfD-ΔC的產物比GtfC-ΔC的產物具有更高的DPs。
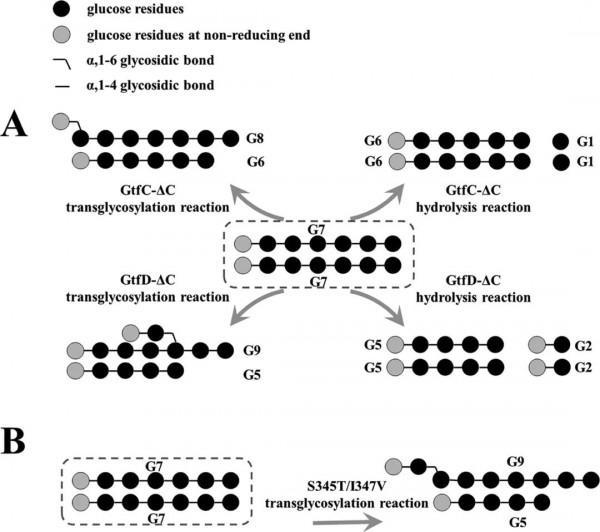
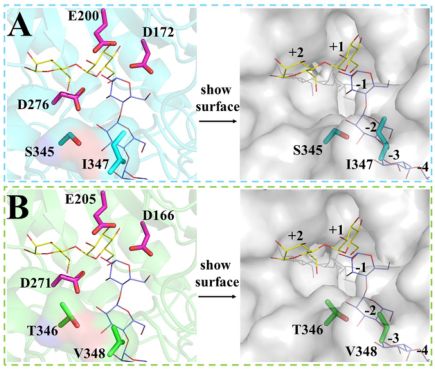
雖然GtfD-ΔC和GtfC-ΔC的氨基酸序列具有很高的同源性,但它們產生了兩種不同結構的產物,並表現出不同的鏈長轉移模式。作者認為GtfD-ΔC和GtfC-ΔC的氨基酸序列之間的幾個差異是造成這些差異的原因。首先研究了GtfC-ΔC中保守的S345殘基,它被GtfD-ΔC中的Thr殘基(T346)取代。此外GtfC-ΔC中另一個重要的I347殘基,它被GtfD-ΔC中的Val殘基(V348)取代。這兩個位點(GtfC-ΔC中的S345和I347)位於環B的序列上,並且僅由Gly殘基分隔(Figure 1)。從GtfD-ΔC和GtfC-ΔC的模擬結構可以看出,這兩個殘基位於催化口袋(Figure S4)。S345靠近+1和+2受體結合位點,I347靠近−2和−3供體結合位點(Figure S4A)。突變這兩個氨基酸殘基可能會對受體或供體底物的結合產生潛在的影響。因此,作者構建了三個GtfC-ΔC突變體:單突變體S345T和I347V和雙突變體S345T/I347V。以直鏈澱粉V為底物測定了它們的比活力(Table 1)。
用1H NMR譜和酶指紋圖譜對突變體S345T、I347V和S345T/I347V的產物進行了表徵。在GtfC-ΔC中引入S345T和I347V單一突變後,產物中α,1→6鍵的比例分別從71%降至39%和52%(Table 1)。酶指紋圖譜分析表明,兩個單一突變產物結構中連續的α,1→6鍵(被葡聚糖酶切割)的比例降低,兩個單一突變產物都能被普魯蘭酶明顯水解(Figure S5)。將雙突變體S345T/I347V引入GtfC-ΔC後,產物中α,1→6鍵的比例進一步下降到35%(Table 1)。S345T/I347V的產物不能被葡聚糖酶水解,而普魯蘭酶的水解物增加(Figure S5)。


結果證實,S345T或I347V突變改變了GtfC-ΔC IMMP產物的結構。GtfC-ΔC合成產物主要由連續的α,1→6鍵連線。兩個單突變體都合成了具有交替的α,1→6與α,1→4鍵和連續的α,1→6鍵的產物。雙突變體S345T/I347V合成的產物主要由α,1→6和α,1→4鍵交替連線。此外,在S345T/I347V突變產物的1H NMR譜中沒有發現分支訊號(Figure 3C),且產物不能被異澱粉酶水解。異澱粉酶只在α,1→4,6分支點水解α,1→6鍵。因此,本研究證實S345T/I347V突變體合成的產物是pullulan-like多糖(PLP),由α,1→4和α,1→6鍵交替連線,呈線形。PLP的這種特殊結構不同於α,1→6鍵連續連線的高度分支化的RLP和IMMP的結構,其潛在的功能有待於發現。
4,6-α-GTs的合成機理研究
在用S345T/I347V突變株處理麥芽七糖的反應過程中(Figure S6),S345T/I347V能在反應早期(0−30 min)將麥芽七糖轉化為DP>8的低聚糖。這一結果表明,S345T/I347V的鏈長轉移模式發生了改變,S345T/I347V突變體獲得了轉移含有多個葡萄糖殘基的糖基的能力。
在GtfC-ΔC中引入S345T/I347V突變後,鏈長度轉移模式和產物結構都發生了改變。這一發現表明,產物結構是由鏈長轉移模式決定的,S345和I347的位置可以透過影響鏈長轉移模式來改變產物結構。S345T或I347V單突變體獲得了糖基轉移能力,S345T/I347V雙突變增強了這一能力。最後,作者認為GtfC-ΔC和S345T/I347V突變體催化的反應之間的關鍵差異可以總結如下。在GtfC-ΔC催化的糖基化反應中,只有一個來自供體的葡萄糖基團被轉移到受體的非還原端以生成α,1,→6鍵(Figure 6A)。因此,GtfC-ΔC糖基化產物(IMMP)中的葡萄糖殘基主要由連續的α,1→6鍵連線。在S345T/I347V催化的糖基化反應中,酶每次將糖基(由α,1→4鍵連線)從供體轉移到受體的非還原端,併發生新的α,1→6糖基化反應(Figure 6B)。因此,S345T/I347V突變體合成了一個由α,1→4和α,1→6鍵交替連線的線性PLP產物。此外,作者還提出了GtfD-ΔC透過糖基轉移來合成由α,1→4和α,1→6鍵交替連線的支鏈RLP(Figure 6A)。然而,GtfD-ΔC序列中的其他關鍵氨基酸殘基可能決定分支點的形成,作者正在進一步鑑定這些殘基。本研究的發現對於透過工程4,6-α-GT生產具有潛在應用價值的膳食纖維具有重要意義。
文章資訊:
PMID:34845909
DOI:10.1021/acs.jafc.1c05263
文章連結:https://doi.org/10.1021/acs.jafc.1c05263